


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
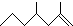 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.
(3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
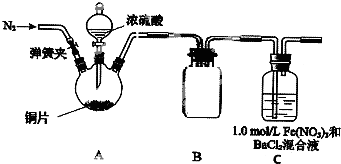 某研究小组探究SO2和Fe(NO3),溶液的反应.
某研究小组探究SO2和Fe(NO3),溶液的反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解.结论:该溶液中有SO42- |
| B、向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝.结论:该溶液中有NH4+ |
| C、向1 mL浓度均为0.05 mol?L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol?L-1的AgNO3溶液,振荡,沉淀呈黄色. 结论:Ksp(AgCl)<Ksp(AgI) |
| D、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀.结论:X中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取5.68克Na2CO3固体 |
| B、用量筒量取30.26 ml液体 |
| C、向小试管中加入100 ml液体 |
| D、用胶头滴管取约1 ml液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?(CH3COO-) |
| c(CH3COOH) |
| A、当向该溶液中加入一定量的硫酸时,K值增大 |
| B、升高温度,K值增大 |
| C、向醋酸溶液中加水,K增大 |
| D、向醋酸溶液中加氢氧化钠,K增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com