
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
关于下列装置的说法,正确的是
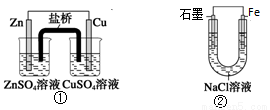
A. 装置①中,盐桥中的K+移向CuSO4溶液
B. 装置①中,Zn为负极,发生还原反应
C. 装置②中的Fe发生析氢腐蚀
D. 装置②中电子由Fe流向石墨,然后再经溶液流向Fe
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:简答题
三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]•3H2O)有很重要的用途.可用如图流程来制备.根据题意完成下列各题:

(1)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填写)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4﹣被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4﹣,被还原成Mn2+.
(2)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;
主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀.
(3)步骤2中,加入锌粉的目的是 .
(4)步骤3中,发生反应的离子方程式为: .
(5)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”、“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体(是物质的量之比为4:5的混合气体).研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A. Mg2+的结构示意图: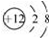 B. 葡萄糖的结构简式:C6H12O6
B. 葡萄糖的结构简式:C6H12O6
C. H2O2的电子式: D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
下列反应中,属于加成反应的是
A. CH2===CH2+H2O CH3CH2OH
CH3CH2OH
B. CH2===CHCH3+Cl2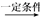 CH2===CHCH2Cl+HCl
CH2===CHCH2Cl+HCl
C. 
D. CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
下列物质中含有共价键的离子化合物是
A. CaCl2 B. NH4HCO3 C. Na2O D. H2O2
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
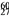 Co在核治疗肿瘤上有着广泛的应用。下列关于
Co在核治疗肿瘤上有着广泛的应用。下列关于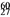 Co的说法正确的是
Co的说法正确的是
A. 质量数是27 B. 质子数是27 C. 电子数是33 D. 中子数是60
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:填空题
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能如下:
化学键 | H—H | Cl—Cl | Cl—H |
键能/(kJ·mol-1) | 436 | 243 | 431 |
请计算H2(g)+Cl2(g) === 2HCl(g)的反应热
A. +862 kJ·mol-1 B. +679 kJ·mol-1 C. -183 kJ·mol-1 D. +183 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com