
| 温度 | 250℃ | 300℃ | 350℃ |
| 平衡常数K | 2.041 | 0.270 | 0.012 |
| (2-0.4)mol |
| 2mol |
| 0.8 |
| 0.2×1.42 |


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、1mol/L |
| B、2.5mol/L |
| C、5mol/L |
| D、2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性溶液中:Fe2+、Ag+、NO3-、I- |
| B、pH=1的溶液中:Na+、[Al(OH)4]-、K+、SO32- |
| C、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、水电离的c(H+)=10-12mol?L-1的溶液中:Cl-、HCO3-、NH4+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色,退色的原因相同 |
B、用KMnO4酸性溶液鉴别CH3CH═CHCH2OH和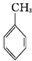 |
| C、乙炔既能使溴水退色,又能使酸性KMnO4溶液退色 |
| D、光照下2,2-二甲基丙烷与Br2反应其一溴取代物有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.使甲基橙呈黄色的溶液:Na+、NO-3、I-、K+ |
| B、.含大量Al3+的溶液:Na+、NO-3、SO2-4、HCO-3 |
| C、.由水电离出的c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、.加入Al产生氢气的溶液:K+、SO2-4、Cl-、NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②⑤ | C、②④ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(OH)2+CO2═CaCO3↓+H2O |
| B、CO2+C═2CO |
| C、Fe2O3+3C═4 Fe+3 CO2 |
| D、C+2H2O═2H2+CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com