
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。

(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
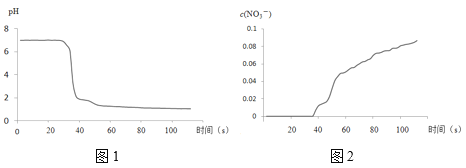
(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。
【答案】3NO2+H2O=2H++2NO3-+NO 排出装置中的氧气(空气) 有红棕色气体生成 BCD 圆底烧瓶中浓硝酸的挥发
【解析】
打开K1、K3、K5,关闭K2、K4,通入一段时间N2,排出装置中的氧气(空气);打开K2,放入足量浓HNO3,打开pH传感器和NO3-传感器,铜与浓硝酸发生反应生成硝酸铜、二氧化氮和水;打开K4,用注射器将少量空气注入三颈瓶,三颈瓶内的气体从无色变为浅红棕色的现象可知,二氧化氮与水反应生成一氧化氮和硝酸,生成的一氧化氮被氧气氧化又生成了二氧化氮。
(1)NO2与水反应生成硝酸和一氧化氮,化学反应方程式为:3NO2+H2O=2HNO3+NO,离子反应方程式为:3NO2+H2O=2H++2NO3-+NO,故答案为:3NO2+H2O=2H++2NO3-+NO;
(2)一氧化氮易被空气中的氧气氧化生成二氧化氮,所以通入N2排出装置中的氧气(空气),故答案为:排出装置中的氧气(空气);
(3)步骤II中圆底烧瓶内铜与浓硝酸发生反应生成硝酸铜、二氧化氮和水,所以溶液变为蓝绿色,有红棕色气体生成,故答案为:有红棕色气体生成;
(4)A. 圆底烧瓶中铜与浓硝酸发生反应生成硝酸铜、二氧化氮和水,溶液变为蓝绿色说明生成硝酸铜,不能验证NO2与水反应产物,A错误;
B. 三颈瓶内气体从无色变为浅红棕色,说明一氧化氮与氧气反应生成了二氧化氮,能验证NO2与水反应生成的产物,B正确;
C. pH传感器是用来检测被测物中氢离子浓度并转换成相应的可用输出信号的传感器,随着反应的进行,pH传感器记录所得数据表示,pH减小,酸性增强,能验证NO2与水反应生成的产物,C正确;
D. 随着反应的进行,NO3-传感器记录所得数据表示,NO3-的浓度增大,能验证NO2与水反应生成的产物,D正确;故答案为:BCD;
(5)浓硝酸易挥发,该实验不严谨,有可能导致传感器所记录的数据结构式圆底烧瓶中挥发出来的浓硝酸,故答案为:圆底烧瓶中浓硝酸的挥发。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母代表一种元素,请根据要求回答问题。
族 周期 | ⅠA | 0 | |||||||
1 | a | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | b | c | d | ||||||
3 | e | f | g |
(1)元素g在元素周期表的位置为____________________。
(2)b和g两种元素的原子半径大小关系:b______g(填“>”或“<”).
(3)由原子个数比为1:1:1的a、b、c三种元素组成的共价化合物X,共形成4对共用电子对,则X的结构式为______________。
(4)f的最高价氧化物与e的最高价氧化物对应的水化物在溶液中反应的离子方程式为_________________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
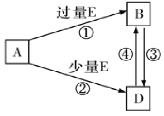
①E的电子式为_______________,B的化学式为____________________。
②A中的化学键类型为____________________
③自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5mo/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)![]() SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
3SiH2Cl2(g)![]() SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
则反应4SiHCl3(g)![]() SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
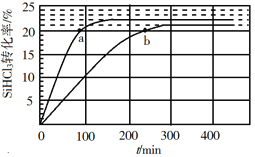
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]()
![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为ω1,物质的量浓度为c1的较浓氨水沿玻璃棒加入到VmL水中,稀释后得到溶质质量分数为ω2,物质的量浓度为c2的稀氨水。若c1=2c2,则( )
A.ω1>2ω2,V>50
B.ω1<2ω2,V<50
C.ω1=2ω2,V<50
D.ω1>2ω2,V<50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数与s电子数相等 |
C基态原子的价电子排布为nsn-1npn+1 |
D的能层数与C相同,且电负性比C大 |
E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
F是前四周期中电负性最小的元素 |
G在周期表的第五列 |
(1)C基态原子中能量最高的电子,其电子云在空间有____个方向,原子轨道呈____形,C简单离子核外有___种运动状态不同的电子。
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是___;
②A2B2难溶于CS2,简要说明理由:________。
(3)G位于____族___区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为____;
(4)ED3分子的VSEPR模型名称为____,其中E原子的杂化轨道类型为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
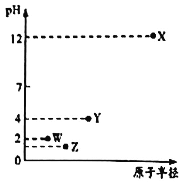
A.简单离子半径:X>Y>Z>W
B.Z与X形成的化合物的水溶液pH>7
C.气态氢化物的稳定性:Z>W>Y
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中![]() 随n(NaOH)的变化如图所示。下列说法正确的是
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l) △H=+267kJmol-1
N2(g)+H2O(l) △H=+267kJmol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJmol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJmol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com