
| A、原溶液一定不存在较大浓度的H+、Mg2+ |
| B、原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5:2:1 |
| C、不能确定原溶液是否含有K+、NO3- |
| D、实验中产生的棕色气体遇空气颜色会加深 |
| 2g |
| 100g/mol |
| 6.16g |
| 154g/mol |
| 2g |
| 100g/mol |
| 6.16g |
| 154g/mol |
| 2g |
| 100g/mol |
| 6.16g |
| 154g/mol |


科目:高中化学 来源: 题型:

| A、该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 |
| B、取10 mL该硫酸于烧杯中,再加入10mL的水,可配得49%的硫酸 |
| C、配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL |
| D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L氢气中含有氢分子的数目为NA |
| B、1 mol臭氧(O3)中含有氧原子的数目为2NA |
| C、常温常压下,14g氮气含有的原子数目为NA |
| D、0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其它分散系的本质特征是具有丁达尔现象 |
| B、根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 |
| C、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
| D、强电解质溶液的导电能力一定强于弱电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与氢气的反应 |
| B、氯气与甲烷的反应 |
| C、氟气与氢气的反应 |
| D、次氯酸的分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
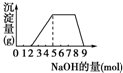 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:[已知:Mg2++2OH-═Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于水;NH4++OH-═NH3?H2O]由此可知,该溶液中肯定含有的离子是
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:[已知:Mg2++2OH-═Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于水;NH4++OH-═NH3?H2O]由此可知,该溶液中肯定含有的离子是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com