
| ||
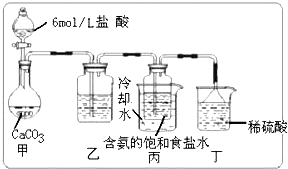


科目:高中化学 来源: 题型:
| A、标准状况下22.4L 氦气含有2NA个氦原子 |
| B、0.5mol/L碳酸钠溶液中,CO32-小于0.5NA |
| C、0.1mol OH-含NA个电子 |
| D、1.8g重水(D2O)中含NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定含CO32- |
| B、加入KSCN溶液,无明显现象,再滴加几滴新制氯水,溶液变为血红色,则试样中一定含Fe2+ |
| C、加入BaCl2溶液,产生白色沉淀,再加入过量的稀盐酸酸化,沉淀不溶解,则试样中一定含SO42- |
| D、在酒精灯火焰上灼烧,火焰为黄色,则试样中一定含钠元素,一定不含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以用NaOH溶液来检验FeCl3溶液中混有的Fe2+ |
| B、受NH4+检验方法的启发,可以通过将NO3-转化成NO的方式来检验 |
| C、取待测液于试管中,先加稀硝酸酸化,再加Ba(NO3)2溶液,若产生白色沉淀,则待测液中一定有SO42- |
| D、取待测液于试管中,加入足量的稀盐酸,若产生使澄清石灰水变混浊的无色无味气体,则待测液中一定有大量CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com