
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
科目:高中化学 来源: 题型:
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
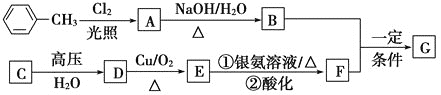
(1)G的结构简式为_________。
(2)指出下列反应的反应类型:A转化为B:________,C转化为D:__________。
(3)写出下列反应的化学方程式
D生成E的化学方程式:___________________。
A生成B的化学方程式:__________________。
(4)符合下列条件的G的同分异构体有________种。
a.苯环上有3个取代基,且有两个取代基相同;
b.能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
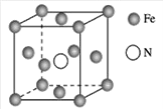
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下2.2gCO2中含有共用电子对的数目为2NA
B.18g D2O中含有的电子总数为10NA
C.在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA
D.1 mol Na2O2所含阴离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
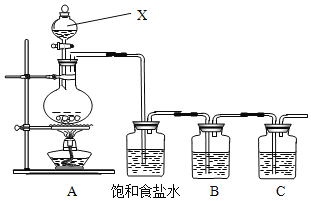
(1)请写出A装置中发生反应的化学方程式___。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是___(选填下列所给试剂的编号),反应离子方程式是__。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:______________________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④HCl酸性比H2S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3![]() HCO3-+ Na+
HCO3-+ Na+
B. NaHSO4:NaHSO4=Na+ +HSO4-
C. CH3COONH4:CH3COONH4=NH4++CH3COO-
D. Fe(OH)3:Fe(OH)3![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是(阿伏伽德罗常数为NA)( )
A.氯气跟水反应的离子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的离子总数为0.6NA
C.11克D218O中含有的中子数为6NA
D.![]() 和
和![]() 质子数相同,但属于不同种核素
质子数相同,但属于不同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
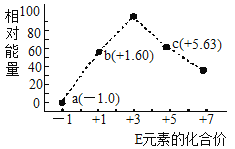
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com