
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下2.2gCO2中含有共用电子对的数目为2NA
B.18g D2O中含有的电子总数为10NA
C.在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA
D.1 mol Na2O2所含阴离子数为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①Li+能量最低的激发态的电子排布图为______________________。
②第四电离能I4(Co)比I4(Fe)小,原因是______________________。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(![]() )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为____________________。
②碳酸亚乙酯分子中碳原子的杂化方式为___________________;碳酸亚乙酯能溶于水的原因是______________________________________________________。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(![]() ),
),![]() ;
;![]() ;……
;……
锂离子:![]() ;
;![]() ;
;![]() ;
;![]() ;……
;……
①在图上画出硫化锂晶胞沿x轴投影的俯视图。___________
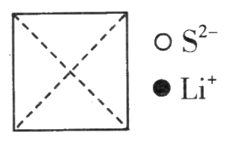
②硫离子的配位数为__________________。
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】王浆酸是从蜂王浆中分离出的一种有机酸,它有很好的杀菌、抗癌、抗放射及强化机体、增强免疫力的作用,其结构如下所示。有关王浆酸的说法不正确的是( )
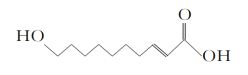
A. 分子式为C10H18O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下能发生取代反应和氧化反应
D. 1 mol王浆酸最多能中和2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究K2FeO4的性质。制备原理:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)。
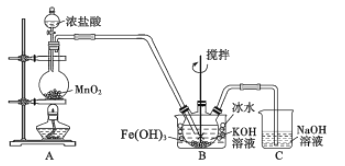
(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是________________,此装置存在一处明显缺陷,请指出___________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_________。
(5)查阅资料知,K2FeO4能将 Mn2+氧化成 MnO4-。该小组设计如下实验进行验证:
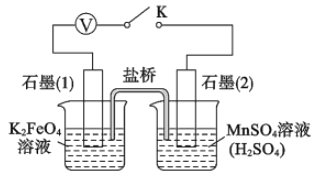
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是_______;写出上图中负极的电极反应式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗的值, 已知HCl气体的质量为3.65g
(1)HCl的物质的量为_______________
(2)HCl的分子个数为_______________
(3)原子总数为 _______________
(4)在标准状况的体积为________________
(5)所含电子数为 _________________
(6)如把 HCl完全溶于水配置成1L 溶液,该溶液中H+的物质的量浓度为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烃A在同温、同压下蒸气的密度是H2的35倍,其分子式为________。
(2)3—甲基—1一丁炔的结构简式为________
(3)![]() 的分子式为__________
的分子式为__________
(4)分子式为C8H10属于芳香烃的同分异构体共有______种,其中_______(结构简式)在苯环上的一氯取代产物有两种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com