

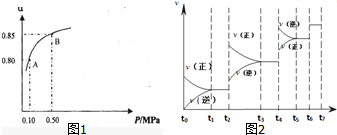
分析 (1)同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,根据图知,
1min时,△n(X)=(0.7-0.4)mol=0.3mol、△n(Y)=(1.0-0.4)mol=0.6mol,X、Y的计量数之比=0.3mol:0.6mol=1:2,据此判断二氧化氮代表曲线;
(2)若升高温度,正逆反应速率都加快;
(3)同一化学反应中,用不同物质表示反应速率时,把不同物质转化为同一种物质,数值大的反应速率快,但单位必须相同;
(4)在0到1min中内用X表示该反应的速率=$\frac{\frac{0.3mol}{2L}}{1min}$;该反应达限度时,Y的转化率=$\frac{0.6mol}{1.0mol}×100%$,反应开始时与反应达平衡状态的压强之比等于其物质的量之比.
解答 解:(1)同一可逆反应同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,根据图知,
1min时,△n(X)=(0.7-0.4)mol=0.3mol、△n(Y)=(1.0-0.4)mol=0.6mol,X、Y的计量数之比=0.3mol:0.6mol=1:2,二氧化氮的计量数是2,所以二氧化氮代表曲线是Y,故答案为:Y;
(2)若升高温度,增大活化分子百分数,所以正逆反应速率都加快,故答案为:加快;加快;
(3)同一化学反应中,用不同物质表示反应速率时,把不同物质转化为同一种物质,数值大的反应速率快,但单位必须相同,甲中v(NO2)=18mol/(L•min),乙中v(N2O4)=0.2mol/(L•s)、v(NO2)=2v(N2O4)=0.4mol/(L•s)=24mol/(L.min),所以乙的反应速率较快,故答案为:乙;
(4)在0到1min中内用X表示该反应的速率=$\frac{\frac{0.3mol}{2L}}{1min}$=0.15mol/(L.min);该反应达限度时,Y的转化率=$\frac{0.6mol}{1.0mol}×100%$=60%,反应开始时与反应达平衡状态的压强之比等于其物质的量之比,反应前混合气体物质的量是1.4mol,平衡时混合气体物质的量=(0.7+0.4)mol=1.1mol,所以反应前后压强之比=1.4mol:1.1mol=14:11,
故答案为:0.15mol/(L.min);60%;14:11.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,知道化学反应速率快慢比较方法,但比较时单位必须相同,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸和油脂都能与氢氧化钠溶液反应 | |
| B. | 检验乙醇中是否含有水可加入少量无水硫酸铜,若变蓝色则含水 | |
| C. | 在淀粉溶液中加入20%的稀硫酸水解后,立即加入新制Cu(OH)2悬浊液共热,证明有葡萄糖生成 | |
| D. | 在鸡蛋白溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加入蒸馏水振荡,沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度时,溶液的导电能力的强弱 | |
| B. | 在水溶液里电解质是否全部电离为离子 | |
| C. | 是离子化合物还是共价化合物 | |
| D. | 强电解质易溶于水,弱电解质难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
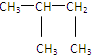 ⑩
⑩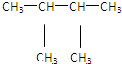 ⑪${\;}_{17}^{35}$Cl⑫
⑪${\;}_{17}^{35}$Cl⑫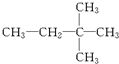
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(碱)=10V(酸) | B. | V(酸)=10V(碱) | C. | V(酸)=2V(碱) | D. | V(酸)=V(碱) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com