
����Ŀ�������£��ú��ܷ���(��Ҫ�ɷ�ΪCoCO3������������NiCO3����м)�Ʊ�CoCl26H2O�Ĺ���������ͼ��
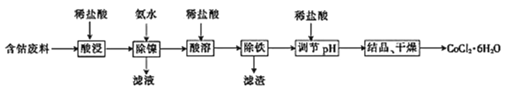
����֪������������ҺpH���ܵĻ����ʼ�Ni2+������Ӱ����ͼ��ʾ��
�ڲ��ֽ�����������ʵ�������¿�ʼ��������ȫ������pH�����ʾ��
���������� | ��ʼ����pH | ��ȫ����pH |
Fe3+ | 1.5 | 4.0 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 7.7 | 9.5 |
�ش��������⣺
(1)�������Һ�е�������Ϊ��Co2+��Ni2+��__��
(2)����ʱ��Ӧ������ҺpH=__����ʱNi2+�Ƿ��γ�Ni(OH)2������___(�ǻ��)����pH��С�����Ʒ���Ȼ�___(���ߣ����ͣ���)��
(3)����ʱ��������pH=8ʱ����Һ��n(Fe3+)��n(Co2+)=__��
��֪Ksp[Co(OH)2]=2.0��10-16��Ksp[Fe(OH)3]=4.0��10-38��
(4)����ʱ������Һ�м���30%��H2O2���������ӷ�Ӧ����ʽ�ǣ�__����ַ�Ӧ��������Һ�м���CoCO3��������ҺpH��ΧΪ__��ʹFe3+��ȫת��ΪFe(OH)3�����������˵õ�CoCl2��Һ��
(5)��֪Ag++SCN-=AgSCN����Ϊ�ⶨ�ֲ�Ʒ��CoCl26H2O�ĺ�������ȡ11.9g�ֲ�Ʒ���100mL��Һ������ȡ��25mL�ȼ��뺬0.03mol��AgNO3��(���ʲ����䷴Ӧ)������0.5mol/L��KSCN��Һ�궨������AgNO3���ñ궨�������õ�ָʾ��Ϊ__(�ѧʽ)��������20.00mL��KSCN��Һ����ôֲ�Ʒ��CoCl26H2O����������Ϊ__��
���𰸡�Fe2+��H+ 10 �� ���� 2.0��10-16��1(��2.0��10-16) 2Fe2++H2O2+2H+=2Fe3++2H2O 4.0��pH��6.6 Fe(NO3)3 80%
��������
���ܷ���(��Ҫ�ɷ�ΪCoCO3������������NiCO3����м)��ϡ����������õ���Co2+��Ni2+��Fe2+����Һ���Ӱ�ˮ����pH��Co2+��Fe2+���������ˣ�������м�����������õ���Co2+��Fe2+��Һ������Һ�еμ�����30%H2O2������Fe2+�õ�Fe3+������Һ�м���CoCO3��������ҺpHΪ4.0��pH��6.6��ʹFe3+������ȫ�����˵�CoCl2��Һ����ѹ������Һ���ᾧ�����CoCl26H2O��
(1)̼���ܺ�̼���������ᷴӦ������Ӧ���Ȼ�������ˮ���������м���ᷴӦ����Fe2+��H2��ͬʱʣ����Һ�л��й��������ᣬ����Һ�е������ӳ���Co2����Ni2�����⣬����Fe2+��H+��
(2)��ͼ��֪���������в�Ʒ���ܵĻ�����������ҺpH����������ͣ���Ʒ����Ԫ�صĺ�����pH=10�Ժ����䣬pH=10ʱ��Co�Ļ����ʸ���Ni�ĺ����ͣ�����Ӧ����pHΪ10������ʱ��CoԪ����������NiԪ������Һ�У�δ�γɳ�������pH��С����������ȫ����Һ����Ԫ�صĺ����������Ʒ�Ĵ��Ȼή�ͣ�
(3)�����£�����ʱ����������Һ��pHΪ8ʱ����Һ��c(OH)=![]() mol/L=1��10-6mol/L����Ksp[Co(OH)2]��c(Co2��)��c2(OH)=2.0��10��16������c(Co2��)=
mol/L=1��10-6mol/L����Ksp[Co(OH)2]��c(Co2��)��c2(OH)=2.0��10��16������c(Co2��)=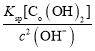 =
=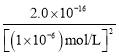 =2.0��10-4��ͬ����֪c(Fe3��)=
=2.0��10-4��ͬ����֪c(Fe3��)=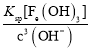 =
=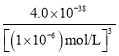 =4.0��10-20����Һ�����һ��������Һ�е�n(Fe3��)��n(Co2��)��c(Fe3��)��c(Co2��)=
=4.0��10-20����Һ�����һ��������Һ�е�n(Fe3��)��n(Co2��)��c(Fe3��)��c(Co2��)=![]() =2.0��10-16��1=2.0��10-16��
=2.0��10-16��1=2.0��10-16��
(4)����ʱ��������Һ�еμ�����30��H2O2��Һ����Fe2������ΪFe3���������ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O����ַ�Ӧ��������Һ�м���CoCO3��������ҺpH��ʹFe3+��ȫת��ΪFe(OH)3����������pH��4.1����Ҫ��֤��Һ�е�Co2������������pH<6.6�������˵�pH��ΧΪ��4.0��pH��6.6��
(5)Ϊ��ֹ�����������������ӷ�����Ӧ���ڲ��������п�ѡ��Fe(NO3)3(�������Ӻ�����������������ɳ������������Ȼ�����������)��Ϊָʾ����
Ag����SCN��==AgSCN������KSCN���ĵ�Ag�������ʵ���n(Ag��)=n(SCN��)=0.5mol/L��20��10-3L=0.01mol�������AgNO3�����ʵ���Ϊ0.03mol��˵����CoCl2��6H2O��Ӧ��AgNO3�����ʵ���Ϊ0.03mol-0.01mol=0.02mol�����ݹ�ϵʽAg��![]() Cl
Cl![]() CoCl2��6H2O��֪��25mL����Ʒ��CoCl2��6H2O�����ʵ���Ϊ
CoCl2��6H2O��֪��25mL����Ʒ��CoCl2��6H2O�����ʵ���Ϊ![]() ��0.02mol=0.01mol��100mL��Һ�е�CoCl2��6H2O������Ϊ
��0.02mol=0.01mol��100mL��Һ�е�CoCl2��6H2O������Ϊ![]() ��0.01mol��238g/mol=9.52g����ôֲ�Ʒ��CoCl2��6H2O����������Ϊ
��0.01mol��238g/mol=9.52g����ôֲ�Ʒ��CoCl2��6H2O����������Ϊ![]() ��100%=80%��
��100%=80%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����( )
A.BrCH2CHBrCH2Br�������������
B.�ʰ���ͱ�����������ˮ���ģ���������4�ֶ���
C.����(![]() )�ϵ�һ��H ԭ�ӱ���C4H9 ȡ����IJ��ﹲ��32��
)�ϵ�һ��H ԭ�ӱ���C4H9 ȡ����IJ��ﹲ��32��
D.C3H6 ��C4H8 ��һ����ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ҫ��ҽҩ�м��塣��A��BΪԭ�Ϻϳɱ�����������F��·����ͼ��
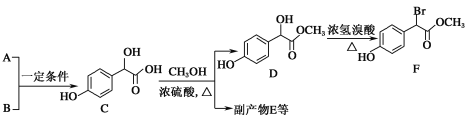
��1��A����ʽΪC2H2O3���ɷ���������Ӧ���Ҿ������ԣ�A��������������Ϊ__��B����ʽΪC6H6O��д��A��B��C�Ļ�ѧ��Ӧ����ʽ��__��
��2��C(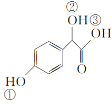 )�Т١��ڡ���3����OH��������ǿ������˳����__��
)�Т١��ڡ���3����OH��������ǿ������˳����__��
��3��1molF��һ��������������NaOH��Һ��Ӧ���������NaOH�����ʵ���Ϊ__mol����������������F��ͬ���칹��(�����������칹)����___�֡�
������̼��������Һ��Ӧ�ڱ�����ֻ��2��ȡ����������һ�����ǻ�
��4����֪��R��CH2��COOH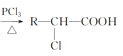 ��A�ж��ֺϳɷ������ڷ�����д��������ϳ�A��·������ͼ(����ԭ����ѡ)___��
��A�ж��ֺϳɷ������ڷ�����д��������ϳ�A��·������ͼ(����ԭ����ѡ)___��
�ϳ�·������ͼʾ�����£�H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ�����е缫a���ò���ʯīϩ��S8���ϣ���ط�ӦΪ��16Li+xS8=8Li2Sx��2��x��8��������˵����ȷ����

A. ��ع���ʱ�������ɷ�����Ӧ��2Li2S6+2Li++2e-=3Li2S4
B. ��س��ʱ��Խ��������е�Li2S2��Խ��
C. ������м�����������ǿ������
D. ��ع���ʱ�����·������0.02 mol���ӣ��������ϼ���0.14 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��й����ʵ��ܶȻ����£������й�˵������ȷ����( )
���� | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96��10-9 | 6.82��10-6 | 4.68��10-6 | 5.60��10-12 | 2.80��10-39 |
A.�����£���ȥNaCl��Һ�е�MgCl2���ʣ�ѡ��NaOH��Һ��Na2CO3��ҺЧ����
B.�����£���ȥNaCl��Һ�е�CaCl2���ʣ�ѡ��NaOH��Һ��Na2CO3��ҺЧ����
C.����Mg2+��Fe3+����Һ�еμ�NaOH��Һ�������ֳ�����������Һ��pH=8ʱ��c(Mg2+)��c(Fe3+)=2.0��10-21
D.��������Ca(OH)2��������100mLˮ�У��պôﵽ����[c(Ca2+)=1.0��10-2mol/L]���������¶Ȳ��䣬�����м���100mL0.012mol/L��NaOH�������Һ��Ϊ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ���������ε�����a��b��c��d��e��f������ЩԪ����ɵĻ����a��һ����Ҫ��;Ϊ�����Դ��d�ǵ���ɫ��ĩ��mΪԪ��Y�ĵ��ʣ�ͨ��Ϊ��ɫ��ζ�����塣�������ʵ�ת����ϵ��ͼ��ʾ������˵���������ǣ� ��
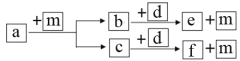
A.�����Ӱ뾶��Z��Y
B.�����ӵĻ�ԭ�ԣ�Y��W
C.����̬�⻯������ȶ��ԣ�Y��X
D.W2Y2�к��зǼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������Ա�Ϊ��Ҫԭ�ϣ���ȡ����·�ߺϳ�����ҩ���������ӡ�
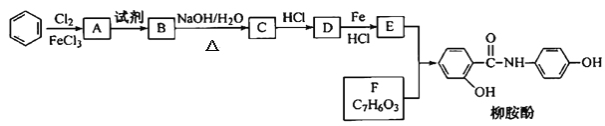
��֪����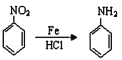
��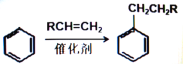 ��RΪ������Hԭ�ӣ�
��RΪ������Hԭ�ӣ�
�ش��������⣺
��1�����������ӣ�����˵����ȷ����___������ţ���
A.1mol�����������Ժ�2molNaOH��Ӧ
B.���ܷ���������Ӧ
C.�ɷ���ˮ�ⷴӦ
D.�����巢��ȡ����Ӧ
��2��д��A��B��Ӧ������Լ�___��
��3��д��B��C�Ļ�ѧ����ʽ___��
��4��д��������F�Ľṹ��ʽ____��
��5��д��ͬʱ��������������F��ͬ���칹��Ľṹ��ʽ___��д��1�֣���
�����������ұ����������ֲ�ͬ��ѧ��������ԭ�ӣ����ܷ���������Ӧ
��6���Ա�����ϩΪԭ�Ͽɺϳɾ۱���ϩ������ƺϳ�·��___�����Լ����ܼ���ѡ����
ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵļ�������������
A.�ü������������ʳ��ˮ�͵�������Һ
B.����Һ�е������軯����Һ���ɼ�����Һ���Ƿ����Fe2+
C.����ɫʯ����ֽ�쵽����ƿ�ڿɼ���ƿ���Dz��ǰ���
D.����Һ�е�������ϡ������ٵ����Ȼ�����Һ���ɼ�����Һ���Ƿ����SO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������֪��SiHCl3�ڴ��������¿ɷ������·�Ӧ��
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ��H1=+48kJ��mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ��H2=30kJ��mol1
(1)д����SiHCl3(g)�ֽ����SiH4(g)��SiCl4(g)���Ȼ�ѧ����ʽΪ__��
����298Kʱ����Һ�д������·�Ӧ��A(aq)![]() B(aq)+H2O(l) ��H>0������A�ij�ʼŨ��Ϊ0.180mol��L-1���������B��Ũ����ʱ��仯�����������ʾ��
B(aq)+H2O(l) ��H>0������A�ij�ʼŨ��Ϊ0.180mol��L-1���������B��Ũ����ʱ��仯�����������ʾ��
t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
c/(mol��L��1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
�ش��������⣺
(2)�÷�Ӧ��50��80min�ڵ�ƽ����Ӧ����Ϊ__mol��L1��min1��
(3)120minʱA��ת����Ϊ__��
(4)298Kʱ���÷�Ӧ��ƽ�ⳣ��K=__������ʱƽ�ⳣ��__(����������������С��������������)��
(5)Ϊ���A��ƽ��ת���ʣ����ʵ����Ʒ�Ӧ�¶��⣬���ɲ�ȡ�Ĵ�ʩ��__��
(6)����������˵�����淴Ӧ�Ѵ�ƽ�����__��
A.c(A)=c(B)
B.A��B��Ӧ�������
C.A��B�����ʵ�����ֵ���ֺ㶨
D.��Һ�����������ֺ㶨
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com