
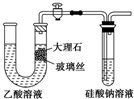
| A、使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) |
| B、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
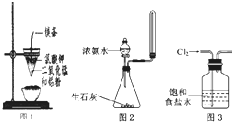
| A、图1装置可制得金属锰,用同样的装置可制得金属铬 |
| B、实验室用图2所示装置制取少量纯净的氨气 |
| C、用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色不能说明该溶液中含有钠元素 |
| D、实验室用图3所示装置除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-4 |
| A、HCN>HNO2>CH3COOH>HF |
| B、HF>HNO2>CH3COOH>HCN |
| C、HCN>CH3COOH>HNO2>HF |
| D、HCN>CH3COOH>HF>HNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com