
| n |
| V |
| 2mol/L×1mL |
| 100mL |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊.该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| C、将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验②中发生反应的离子方程式为:Fe2++Cl2=Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3 |
| B、只做实验①③④,也能达到实验目的 |
| C、通过上述实验可确定该化合物化学式为:(NH4)2Fe(SO4)2?6H2O,是一种浅绿色晶体,商品名为摩尔盐 |
| D、为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从煤中提取煤焦油和从石油中提取煤油 |
| B、乙酸和乙醛都能与新制Cu(OH)2反应 |
| C、乙烯、乙醛都能与溴水反应 |
| D、葡萄糖和福尔马林都能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
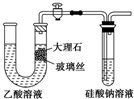
| A、使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) |
| B、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com