解答:
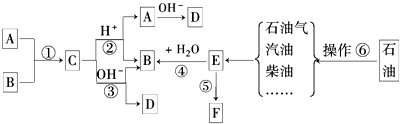
解:①测得溶液A、C、E呈碱性,三种溶液为碱液或水解呈碱性的溶液,且碱性为A>E>C,则A为碱,溶液中含有大量的OH
-离子,OH
-离子与Ag
+,Ca
2+,Fe
2+,Al
3+等离子不能大量共存,故A只能为Ba(OH)
2;根据越弱越水解,E应为碳酸盐,根据离子共存,只能为K
2CO
3,C为醋酸盐;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则B中含有银离子,应为硝酸银溶液,加入氨水发生的反应为:AgNO
3+NH
3?H
2O=AgOH↓+NH
4NO
3、AgOH+2NH
3?H
2O=Ag(NH
3)
2OH+2H
2O;
③向D溶液中滴加Ba(NO
3)
2溶液,无明显现象,说明D中不含SO
42-离子,则SO
42-离子只能存在于F中;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色,说明F中含有Fe
2+离子,结合③可知,F为FeSO
4;剩余的钙离子含在C中,即C为Ca(CH
3COO)
2,
综上分析可知,A为Ba(OH)
2,B为AgNO
3,C为Ca(CH
3COO)
2,D为AlCl
3,E为K
2CO
3,F为FeSO
4,
(1)F中含有亚铁离子,加入氨水后亚铁离子与氨水反应生成氢氧化亚铁,氢氧化亚铁容易被空气中氧气氧化成氢氧化铁,反应的离子方程式为:Fe
2++2NH
3?H
2O=Fe(OH)
2↓+2NH
4+、4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3,
故答案为:Fe
2++2NH
3?H
2O=Fe(OH)
2↓+2NH
4+;4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3;
(2)根据分析可知,E应为碳酸盐,六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,故E为K
2CO
3,
故答案为:碳酸钾;由①中碱性强弱的顺序可知,E是碳酸盐,六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾;
(3)C为Ca(CH
3COO)
2,醋酸根离子在溶液中存在水解平衡:CH
3COO
-+H
2O?CH
3COOH+OH
-,溶液显示碱性,
故答案为:CH
3COO
-+H
2O?CH
3COOH+OH
-;
(4)E为K
2CO
3,A为Ba(OH)
2,常温下pH均为12的K
2CO
3的水溶液中氢氧根离子浓度为0.01mol/L,碳酸钾溶液中的氢氧根离子是水电离的,则水电离的氢离子为0.01mol/L;
pH=12的氢氧化钡溶液中氢氧根离子浓度为0.01mol/L,氢氧化钡溶液中的氢离子为水电离的,则水电离的氢离子浓度为:1×10
-12mol/L,
则两溶液中水电离的氢离子浓度之比为:0.01mol/L:1×10
-12mol/L=10
10:1,
故答案为:10
10:1;
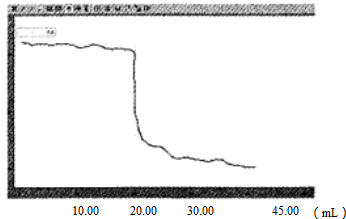
(5)A为Ba(OH)
2,D为AlCl
3,向20mL2mol/LAlCl
3溶液中加入30mlBa(OH)
2溶液,充分反应后得到0.78克沉淀,沉淀为氢氧化铝,
设Ba(OH)
2的浓度为c,当NaOH不足时,
Al
3++3OH
-=Al(OH)
3↓
3mol 78g
0.03L×2c 0.78g
解得:c=
=0.5mol/L;
当Ba(OH)
2使Al(OH)
3部分溶解时,设Ba(OH)
2的物质的量为x,根据反应:
Al
3++3OH
-=Al(OH)
3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)
3+OH
-=AlO
2-+H
2O
78g 1mol
(3.12-0.78)g (2x-0.12mol)
78g×(2x-0.12mol)=1mol×(3.12-0.78)g,
解得:x=0.075mol,
氢氧化钡溶液的浓度为:
=2.5mol/L,
故答案为:0.5或2.5.



 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案