


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
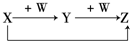 X、Y、Z、W有如图所示的转化关系,则X、W可能是( )
X、Y、Z、W有如图所示的转化关系,则X、W可能是( )| A、①②③ | B、①② |
| C、③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ |
| B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| C、硫酸铜溶液与氢氧化钠溶液混合:CuS04+20H-=Cu(OH)2↓+SO42- |
| D、硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3 |
| B、Mg(HCO3)2 |
| C、H2SO4 |
| D、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体,则一定含有N
| ||
| B、将SO2通入溴水,溴水褪色,说明SO2具有漂白性 | ||
| C、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | ||
| D、在含FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 4 |
- 2 |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| A、烧碱溶液 |
| B、溴水 |
| C、AgNO3溶液 |
| D、淀粉KI试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com