
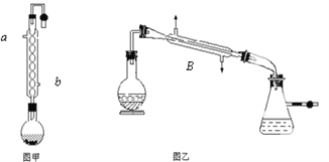
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
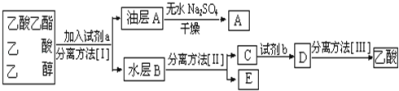
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
【答案】b 冷凝管 防止暴沸 该反应为可逆反应,增大乙醇的量可以提高乙酸的转化率 饱和Na2CO3溶液 分液 蒸馏 乙醇
【解析】
(1)为了达到更好的冷凝效果,冷凝器进水为下口进上口出,B装置的名称是冷凝管,
故答案为:b;冷凝管;
(2) 放入沸石的目的为防止液体暴沸;
答案为:防止暴沸;
(3) 该反应为可逆反应,为了提高乙酸的转化率,实验时加入过量的乙醇,
故答案为:该反应为可逆反应,提高乙酸的转化率;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离;分离油层和水层采用分液的方法即可;对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇,然后水层中的乙酸钠,根据强酸制弱酸,要用硫酸反应得到乙酸,再蒸馏得到乙酸;
故答案为:饱和Na2CO3溶液;分液;蒸馏;乙醇。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.1 mol·L-1盐酸中,Cl-数为NA
B.58 g正丁烷中,共价键数为10 NA
C.常温常压下,2. 24 L O2中氧分子数为0.2NA
D.密闭容器中,3 mol H2和1 mol N2充分反应后原子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊噻嗪是治疗水肿及高血压的药物,其中间体G的一种合成路线如下:
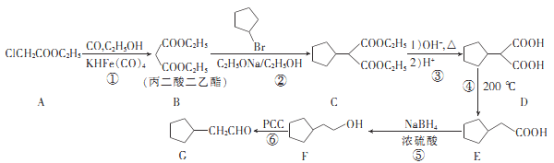
回答下列问题:
(1)A的化学名称是__________。B中含有官能团的名称为___________。
(2)反应②的反应类型是____________。
(3)G与新制Cu(OH)2反应的化学方程式为__________________。
(4)X与E互为同分异构体,X中含有六元碳环,且X能与NaOH溶液反应,则符合条件的X的结构简式为___________________。
(5)设计由1,3-丙二醇和丙二酸二乙酯制备![]() 的合成路线(其他试剂任选)。_____________
的合成路线(其他试剂任选)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NM3是处于临床试验阶段的小分子抗癌药物,分子结构如图。下列说法正确的是
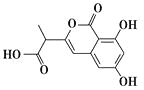
A.该有机物的分子式为C12H12O6
B.1 mol该有机物最多可以和3 mol NaOH反应
C.该有机物容易发生加成、取代、消去等反应
D.该有机物分子中只含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
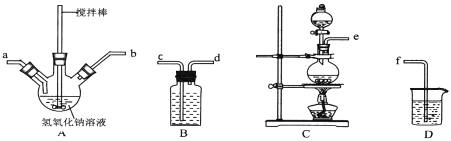
(1)水合肼的制备反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH= N2H4·H2O +NaCl+Na2CO3
①制取次氯酸钠和氢氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为____。
②制备水合肼时,应将__________滴到__________中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
③尿素的电子式为__________________
(2)碘化钠的制备:采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
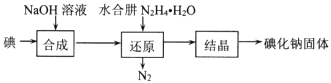
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为 ___。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00 g样品并溶解,在500 mL容量瓶中定容;
b.量取25.00 mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c. 用0.2000 mol·L1的 Na2S2O3标 准 溶 液 滴 定 至 终 点(反 应 方 程 式2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00 mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物 ,下列叙述正确的是( )
,下列叙述正确的是( )
A. 分子间可形成氢键 B. 分子中既有极性键又有非极性键
C. 分子中有7个σ键和1个π键 D. 该分子在水中的溶解度小于2丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3。。下列推断不正确的是( )
A.AB2分子的空间构型为“V”形
B.A---B键为极性共价键,AB2分子为非极性分子
C.AB2与H2O相比,AB2的熔点、沸点比H2O的低
D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种制备氢氧化亚铁的方法,且能保存相对较长时间,根据装置图请回答下列问题:

(1)本实验中为制得氢氧化亚铁如何保证无氧条件_____。
(2)在将硫酸亚铁压入制得氢氧化亚铁的操作之前必须要进行的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l)△H=﹣570kJ/mol,②2H2O(g)=2H2(g)+O2(g)△H=+483.6kJ/mol,③2CO(g)=2C(s)+O2(g)△H=+220.8kJ/mol,④2C(s)+2O2(g)=2CO2(g)△H=﹣787kJ/mol,回答下列问题:
(1)上述反应中属于放热反应的是_____(填写序号)。
(2)H2的燃烧热为_____。
(3)燃烧10g H2生成液态水,放出的热量为______。
(4)H2O(g)=H2O(l)△H=________。
(5)C(s)的燃烧热的热化学方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com