
【题目】(一)甲烷和氯气在光照条件下发生卤代反应,其反应机理如下:
反应①:![]() △H=242.7kJ·mol-1
△H=242.7kJ·mol-1
反应②:![]() △H=7.5kJ·mol-1
△H=7.5kJ·mol-1
反应③:![]() △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1
反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为______。
(2)反应②与反应③的反应过程,如下图所示:
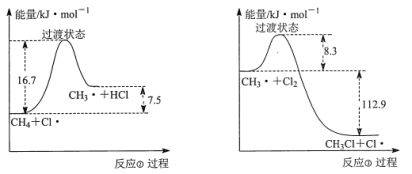
则该条件下,反应②的速率______反应③的速率(填“>”、“<”或“=”)。
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是______。
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应![]() 来处理。
来处理。
(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为______。
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是______。
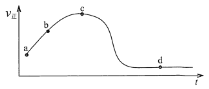
A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:

其中 NaClO2溶液吸收SO2的主要离子反应方程式为______。
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:______。
【答案】355.6kJ < 反应中存在CH3间的碰撞
1.8 AE ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+ 2NOx+4xe-=N2+2xO2-
【解析】
(1)反应①:![]() △H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得;
△H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得;
(2)活化能小的反应反应速率较快;
(3)自由基之间的碰撞产生物质,CH3之间的碰撞可得到乙烷;
(4)NO2与SO2以体积比1:2置于密闭容器中,其物质的量之比也为1:2,令NO2与SO2分别为1mol、2mol,容器体积为VL,设平衡时消耗NO2为x mol列三段式有:
NO2(g)+SO2(g)SO3(g)+NO(g)
n起始: 1 2 0 0
n转化: x x x x
n平衡: 1-x 2-x x x
平衡时NO2和SO2的体积之比为1:5,故(1-x):(2-x)=1:5,解得x=0.75,据此计算;
(5)向恒容密闭容器中通入SO2和NO2,若为恒温,v正随时间变化减小直到不变,绝热条件下,v正随时间变化先增大后减小最终不变,说明温度升高,故该反应为放热反应,d点为平衡状态,根据温度对化学平衡的影响和化学平衡状态特征分析;
(6)根据图可知,吸收后溶液中氯元素以氯离子形式为主,硫元素以硫酸根离子为主,故反应为NaClO2在酸性条件下将二氧化硫氧化为硫酸根离子,自身被还原为氯离子,结合电荷守恒和质量守恒书写可得;
(7)正极得到电子发生还原反应,元素化合价降低,则为NOx放电生成氮气,据此书写。
(1)反应①:![]() △H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得CH3Cl→CH3+Cl,△H=355.6kJ/mol,故在该反应条件下断裂1mol CH3Cl中C-Cl键,需要吸收的能量为355.6kJ;
△H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得CH3Cl→CH3+Cl,△H=355.6kJ/mol,故在该反应条件下断裂1mol CH3Cl中C-Cl键,需要吸收的能量为355.6kJ;
(2)由图有反应②的活化能为16.7kJ/mol,反应③的活化能为8.3kJ/mol,反应③的活化能较低,反应速率较快,反应②的速率<反应③的速率;
(3)因为反应中存在CH3间的碰撞,故生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物;
(4)NO2与SO2以体积比1:2置于密闭容器中,其物质的量之比也为1:2,令NO2与SO2分别为1mol、2mol,容器体积为VL,设平衡时消耗NO2为x mol列三段式有:
NO2(g)+SO2(g)SO3(g)+NO(g)
n起始: 1 2 0 0
n转化: x x x x
n平衡: 1-x 2-x x x
平衡时NO2和SO2的体积之比为1:5,故(1-x):(2-x)=1:5,解得x=0.75;
则该温度下平衡常数K为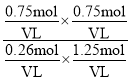 =1.8;
=1.8;
(5)向恒容密闭容器中通入SO2和NO2,若为恒温,v正随时间变化减小直到不变,绝热条件下,v正随时间变化先增大后减小,说明温度升高,故该反应为放热反应;
A.a点正反应速率较b点慢,说明a点的NO2浓度较b点大,颜色比b点深,故A正确;
B.正反应速率与逆反应速率相等,反应到达平衡,c点正反应速率正在变化,反应不是平衡状态,与逆反应速率不等,故B错误;
C.反应为放热反应,若升高温度,有利于逆反应方向,d点SO2的转化率将减小,故C错误;
D.该反应气体体积不变,反应的过程中,反应放热,气体受热膨胀,总体积不变,故容器内气体压强增大,故D错误;
E.若外界条件不发生改变,d点为平衡状态,各组分含量保持不变,故NO2和NO的体积比将保持不变,故E正确;
故答案为AE;
(6)用一定浓度的NaClO2溶液在酸性条件下充分吸收煤燃烧排放的烟气(SO2),根据图可知,吸收后溶液中氯元素以氯离子形式为主,硫元素以硫酸根离子为主,故反应为NaClO2在酸性条件下将二氧化硫氧化为硫酸根离子,自身被还原为氯离子,NaClO2溶液吸收SO2的主要离子反应方程式为:ClO2-+2SO2+2H2O=Cl-+2SO42+4H+;
(7)一极通氨气,另一极通NOx,生成无污染的常见气体和液体,说明生成氮气和水,正极得到电子发生还原反应,元素化合价降低,则为NOx放电生成氮气,电极反应为:2NOx+4xe-=N2+2xO2-。


科目:高中化学 来源: 题型:
【题目】(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________(填下面的选项),加入该氧化剂时,温度不能太高,原因是_________。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________(FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×1038,Ksp[Cu(OH)2]=3.0×1020,通常认为残留在溶液中的离子浓度小于1×105molL1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平达喜是常用的中和胃酸的药物,它的化学成分是AlxMgy(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤、洗涤,沉淀物进行干燥后重1.74g。请计算该试样中:
(1)碳酸根的物质的量_____________;
(2)镁离子的物质的量_____________;
(3)通过计算确定该物质的化学组成为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.如不小心被同样温度的液态水和水蒸气烫伤,往往是被水蒸气烫伤更严重
B.所有有O2参与的反应都是放热反应
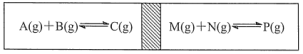
C.绝热密闭容器,中间活塞能自由移动,在两边各加入等量的反应物,发生如图的反应,反应达到平衡后,最终活塞仍处于正中间,则这两个反应放出或吸收的热量相同
D.已知![]()
![]() ,则常温下
,则常温下![]() 完全燃烧放出的热量比
完全燃烧放出的热量比![]() 完全燃烧放出的热量多9kJ
完全燃烧放出的热量多9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验得出的结论正确的是
A.某溶液中加入酸性KMnO4溶液褪色,则原溶液一定含有I-
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含Fe3+
C.通过元素分析测定某无机固体样品的组成是MgH2C2O6,该固体不可能是碱式碳酸镁
D.某碱性水样滴加稀盐酸无沉淀,再加BaCl2溶液,出现白色沉淀,则原水样中一定含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下:
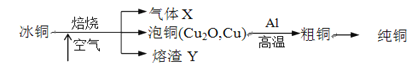
请回答下列问题:
(1)气体X是________。
(2)写出泡铜冶炼粗铜反应的化学方程式_______。
(3)某研究性学习小组用熔渣Y与CO反应来制取Fe(已略去加热装置)。
①请按气流由左到右的方向连接下列各装置,顺序为A→________→尾气处理装置;
②装置C的作用是________________。
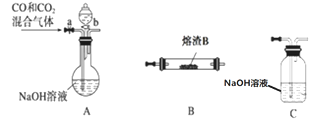

(4)熔渣Y中铁元素的价态有+2价和+3价,为了测定熔渣中二价铁的含量。学习小组取23.2g熔渣用足量硫酸使其完全溶解,向反应后的溶液中加入酸性KMnO4溶液,一共消耗200mL0.1mol/L的KMnO4溶液。
①写出溶液中加入酸性高锰酸钾溶液后发生的离子方程式:________。
②熔渣中二价铁的质量分数为___%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化镁晶体在加热时会发生如下变化:![]() ;
;![]() 。研究人员称取氯化镁晶体ag,经加热后得到固体bg。
。研究人员称取氯化镁晶体ag,经加热后得到固体bg。
已知:
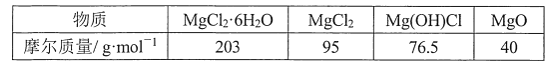
(1)若bg固体为等物质的量的![]() 、MgO混合物,则a与b的关系是____(用分数表示)。
、MgO混合物,则a与b的关系是____(用分数表示)。
(2)若在干燥的HCl气流中加热,得到MgCl2、![]() 的固体
的固体![]() ,则它们的物质的量之比为____。
,则它们的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.摩尔是物质的量的单位
B.36g水中含氢原子数目为4NA(NA表示阿伏加德罗常数的值)
C.在0.5molNa2SO4中,含有的Na+数约是6.02×1023
D.等质量的O2与O3,所含氧原子数之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图
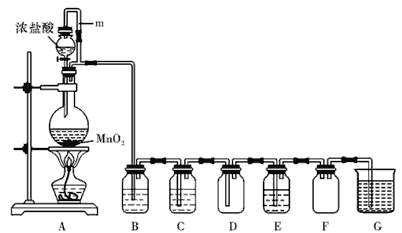
(1)圆底烧瓶中发生反应的化学方程为
(2)若要得到干燥纯净的气体,则B中应盛放的试剂是 C中应盛放的试剂是
(3)E中若装有淀粉碘化钾溶液,能观察到的实验现象是
(4)G中发生反应的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com