
分析 依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式,依据氧化还原反应得失电子守恒计算转移电子数.
解答 解:硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O+2H2O,250℃时,水为气体状态,NH4NO3为固态,
则平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol,
故答案为:NH4NO3$\stackrel{△}{?}$N2O+2H2O;K=c(N2O)×c2(H2O);4.
点评 本题考查硝酸盐的性质、氧化还原反应,题目难度不大,侧重于基础知识的考查,根据元素化合价的变化分析.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 10:2:1 | B. | 5:2:1 | C. | 15:3:2 | D. | 15:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
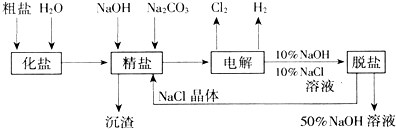
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )| A. | C2H2 | B. | C2H5OH 蒸汽 | ||
| C. | CH4 | D. | CH4与H2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023个碳-12原子就是阿伏加德罗常数 | |
| B. | 1mol氧含6.02×1023个O2分子 | |
| C. | 1molCaCl2中含3mol离子 | |
| D. | 0.5molCl2含1mol氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com