
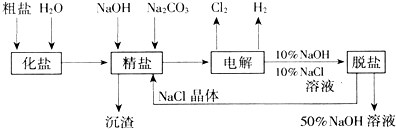
分析 与电源正极相连的电极为电解池的阳极,发生氧化反应,反应的化学方程式为2Cl--2e-═Cl2↑,与电源负极相连的电极为电解池的阴极,发生还原反应,反应的化学方程式为H2O+2e-=2OH-+H2↑,精制过程发生反应为钙离子与碳酸根离子反应生成碳酸钙沉淀,镁离子与氢氧根离子反应生成氢氧化镁沉淀.除去硫酸根离子的同时不能引入新的离子,而氯离子和氢氧根离子溶液中本身就含有,故硝酸钡不行.NaOH的溶解度随温度的升高而变大,NaCl的溶解度随温度的升高基本不变,利用溶解度差异可以除去NaCl.
(1)电解食盐水,与正极相连为阳极,生成氯气,与电源负极相连为阴极,生成氢气和NaOH;
(2)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(5)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法;
(6)根据反应物和生成物写出反应方程式,可理解为氯化钠溶液电解生成氢氧化钠和氯气和氢气,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,两反应相加即可总反应.
解答 解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高,
故答案为:2Cl--2e-═Cl2↑;升高;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,精制过程发生反应的离子方程式为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-=CaCO3↓;Mg2++OH-=Mg (OH)2↓;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以选ac,
故答案为:a、c;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然只有选项bc符合,
故答案为:b、c;
(5)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,所以氢氧化钠和氯化钠分离的方法是:通过加热蒸发结晶、冷却、过滤除去NaCl,
故答案为:蒸发;过滤;
(6)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,Cl2+2NaOH=═NaCl+NaClO+H2O,总的反应为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,
故答案为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
点评 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.


科目:高中化学 来源: 题型:选择题
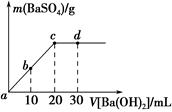 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mol•L-1 Na2SO4溶液中,粒子总数是0.83NA | |
| B. | 1 mol Fe3+完全水解,生成红氧化铁胶体位子的数目为NA | |
| C. | 常温常压下,16g O2和O3的混合气体中所含电子的数目为8NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molH2的质量是1 g | |
| B. | 1 mol HCl的质量是36.5 g•mol-1 | |
| C. | Cl2的摩尔质量等于它的相对分子质量 | |
| D. | SO42-的摩尔质量是96 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com