
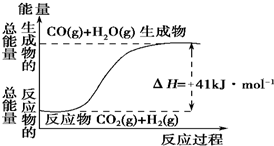
 (1)根据如图所示情况,判断下列说法中正确的是B.
(1)根据如图所示情况,判断下列说法中正确的是B.分析 (1)据图分析,反应物能量小于生成物,正反应吸热,热化学方程式为:CO2(g)+H2(g)=CO(g)+H2O(g)△H=41kJ•mol-1,水由气态变为液态放热;
(2)25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则4g氢气燃烧生成液态水,放出571.6kJ热量;
(3)反应热与化学计量数成正比,依据热化学方程式和盖斯定律,构造所需热化学方程式计算得到.
解答 解:(1)A、该反应热化学方程式为:CO2(g)+H2(g)=CO(g)+H2O(g)△H=41kJ•mol-1,故A错误;
B、反应物能量小于生成物,正反应吸热,故B正确;
C、正反应吸热,故C错误;
D、水由气态变为液态放热,所以该反应吸热减少,其反应热的值小于41kJ•mol-1,故D错误;
故答案为:B;
(2)25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则4g氢气燃烧生成液态水,放出571.6kJ热量,热化学方程式应为2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ•mol-1,故答案为:2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ•mol-1;
(3)已知反应:N2(g)+O2 (g)═2NO(g)△H1 ①;
2H2(g)+O2(g)═2H2O(g)△H2 ②;
N2(g)+3H2(g)═2NH3(g)△H3 ③.
将①×2+②×3-③×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H4=2△H1+3△H2-2△H3,故答案为:2△H1+3△H2-2△H3.
点评 本题考查学生盖斯定律的应用以及化学反应的能量和化学键键能之间的关系,注意知识的迁移和应用是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题:
.塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠、氯水、浓硝酸通常都要密封保存于棕色试剂瓶中 | |
| B. | 盛溴的试剂瓶里加少量水以减少溴的挥发 | |
| C. | 钾、钠、白磷都应保存在水中 | |
| D. | 做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物结构如图,它不可能具有的性质是( )
某有机物结构如图,它不可能具有的性质是( )| A. | ①⑤⑦ | B. | ①②③④⑥⑦ | C. | ⑤⑦ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| B. | 符合通式CnH2n+2的一定是烷烃,符合通式CnH2n的一定是烯烃 | |
| C. | 能发生加成反应的一定是烯烃 | |
| D. | 烷烃中含饱和键、烯烃、炔烃中含不饱和键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,其命名正确的是( )
,其命名正确的是( )| A. | 2-甲基-4-乙基-4-戊烯 | B. | 2-异丁基-1-丁烯 | ||
| C. | 4-甲基-2-乙基-1-戊烯 | D. | 2,4-二甲基-3-己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 1mol甲烷的质量与NA个甲烷分子的质量相等 | |
| C. | 28g氮气含有的原子数目为NA | |
| D. | 1mol碳正离子CH5+所含的电子总数为11NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com