
(1)下表是不同温度下SO2的平衡转化率.[原料气成分(体积分数);SO2 7%,O2 11%,N2 82%;压强;0.1MPa]
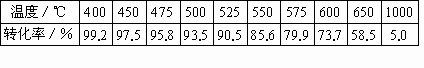
SO2接触氧化是一个放热反应.根据化学平衡理论判断,此反应在温度较低的条件下进行最为有利.但为什么实际生产中,选定400℃~500℃作为操作温度?
(2)压强对SO2平衡转化率的影响[原料气成分同第(1)题]
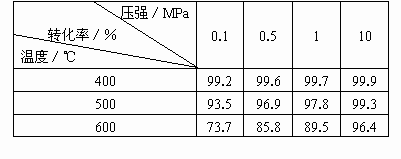
根据化学平衡理论,考虑综合经济效益,结合表中数据,分析回答为什么SO2接触氧化在常压下进行?
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 催化剂 |
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| CO |
| 高温 |
| 稀硫酸 |
| 稀硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 稀硫酸 |
| H2 |
| 高温 |
| 硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
[原料气成分(体积分数):SO2:7%,O2:11%,N2:82%;压强:0.1Mpa]
温度/℃ | 400 | 450 | 500 | 525 | 550 | 575 | 600 | 650 | 1 000 |
转化率/% | 99.2 | 97.5 | 95.8 | 93.5 | 90.5 | 85.6 | 79.9 | 73.7 | 58.5 |
SO2接触氧化是一个放热反应。根据化学平衡理论判断,此反应在温度较低的条件下最为有利。但为什么实际生产中,选定400—500 ℃作为操作温度?
(2)压强对SO2平衡转化率的影响的有关参数如下表[原料气成分同第(1)题]
压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
根据化学平衡理论,考虑综合经济效益,结合表中数据,分析回答为什么SO2接触氧化在常压下进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com