
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).分析 (1)①实验1中6s到达平衡,消耗CO物质的量为4mol-2.4mol=1.6mol,由方程式开始生成二氧化碳为1.6mol,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v (CO2);
②实验1等效为先在实验2的基础上压强增大一倍,平衡不移动,平衡时氢气为实验2中的2倍,即为0.8mol,然后再降低温度,氢气物质的量增大为1.6mol,说明升高温度平衡正向移动;
计算平衡时各组分物质的量,反应前后气体体积不变,用物质的量代替浓度代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算;
(2)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
根据盖斯定律,①×$\frac{1}{2}$-②×$\frac{1}{2}$+③×2可得:CH3OH(l)+O2(g)═CO(g)+2H2O(l),反应热也进行相应的计算;
(3)①正极发生还原反应,氧气在正极获得电子,碱性条件下生成水;
②本质是甲醇燃烧生成二氧化碳与水,生成的二氧化碳与KOH反应生成碳酸钾与水,电解质溶液的pH减小;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)①实验1中6s到达平衡,消耗CO物质的量为4mol-2.4mol=1.6mol,由方程式开始生成二氧化碳为1.6mol,则v (CO2)=$\frac{\frac{1.6mol}{2L}}{6s}$=0.13mol/(L.min),
故答案为:0.13mol/(L.min);
②实验1等效为先在实验2的基础上压强增大一倍,平衡不移动,平衡时氢气为实验2中的2倍,即为0.8mol,然后再降低温度,氢气物质的量增大为1.6mol,说明升高温度平衡正向移动,升高温度平衡向吸热反应移动,故正反应为吸热反应;
实验2平衡时,生成氢气为0.4mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):2 1 0 0
变化量(mol):0.4 0.4 0.4 0.4
平衡量(mol):1.6 0.6 0.4 0.4
反应前后气体体积不变,用物质的量代替浓度计算,故K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.4×0.4}{1.6×0.6}$=$\frac{1}{6}$,
故答案为:吸;$\frac{1}{6}$;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
根据盖斯定律,①×$\frac{1}{2}$-②×$\frac{1}{2}$+③×2可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol;
(3)①正极发生还原反应,氧气在正极获得电子,碱性条件下生成水,正极电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
②本质是甲醇燃烧生成二氧化碳与水,生成的二氧化碳与KOH反应生成碳酸钾与水,电解质溶液的pH减小,该电池总反应的化学方程式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,
故答案为:2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,
故答案为:5.6×10-5mol/L.
点评 本题考查化学平衡计算、热化学方程式书写、原电池、溶度积计算等,(4)为易错点,学生容易将混合溶液中钙离子浓度当中氯化钙溶液浓度.


科目:高中化学 来源: 题型:选择题
| A. | 单质熔、沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 气态氢化物沸点逐渐升高 | D. | 气态氢化物稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
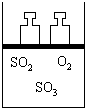 如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:
如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.
一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | Zn具有氧化性和导电性,可用作锌锰干电池的负极材料 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用到金属钠时,要用镊子取、再用小刀切下所需量,剩余的钠不能放回原试剂瓶中 | |
| B. | 大型中央空调的制冷剂可用液氨 | |
| C. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 | |
| D. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com