
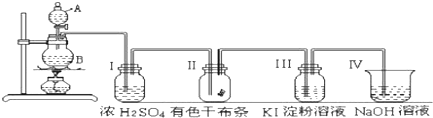


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性溶液中:Fe2+、Ag+、NO3-、I- |
| B、pH=1的溶液中:Na+、[Al(OH)4]-、K+、SO32- |
| C、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、水电离的c(H+)=10-12mol?L-1的溶液中:Cl-、HCO3-、NH4+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol?L-1) | NaOH物质的量浓度 (mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色,退色的原因相同 |
B、用KMnO4酸性溶液鉴别CH3CH═CHCH2OH和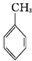 |
| C、乙炔既能使溴水退色,又能使酸性KMnO4溶液退色 |
| D、光照下2,2-二甲基丙烷与Br2反应其一溴取代物有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
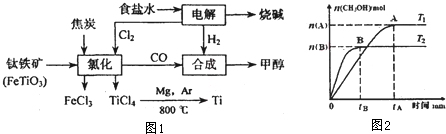
查看答案和解析>>
科目:高中化学 来源: 题型:
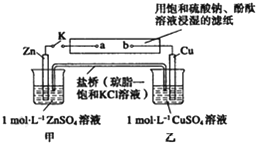
| A、滤纸上a点发生的电极反应为:2H++2e-═H2↑ |
| B、片刻后可观察到滤纸上b点变红色 |
| C、片刻后乙池中c(Cu2+)减小 |
| D、Zn电极上发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com