
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A. NH4+、Al3+、Cl-、HCO3-在溶液中能大量共存
B. H2O2的电子式是: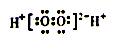
C. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 铁锈是化合物,可用Fe2O3·nH2O(2<n<3)表示
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,W原子的质子数是其最外层电子数的三倍。下列说法不正确的是
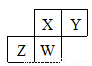
A. 元素Y有同素异形体 B. 最高价氧化物对应水化物的酸性:X>Z
C. 简单气态氢化物的热稳定性:Y>Z D. 原子半径:W>Z>Y>X
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列实验操作和理象、结论均正确且有因果关系的是
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色 | 原溶液中含有I- |
B | 常温下,0.1mol/LNaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
C | 相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH | 亚硫酸的酸性强于碳酸 |
D | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色 | 稀HNO3将Fe氧化为Fe2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:选择题
可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强pl>p2。下列判断正确的是

A. 1+a<b B. △H<0 C. a>b D. 增加L的物质的量,可提高G的转化率
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:选择题
在某温度时,将nmol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
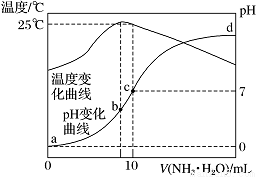
A. n=1.0
B. 水的电离程度:b>c>a>d
C. c点:c(NH)=c(Cl-)=1.0 mol·L-1
D. 25 ℃时,NH4Cl的水解常数(Kh)计算式为=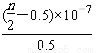
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:填空题
硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,图示如下:

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
则反应I的△H=_______kJ/mol。反应Ⅲ的化学方程式为__________________。
(2)从废钒催化剂中回收V2O5的过程如下:

①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式_________。
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为________[25℃,Ksp(NH4VO3) =1.6×10-3,溶液体积变化忽略不计]。
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,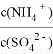 将_______(填“变大”、“不变”或“变小”)。
将_______(填“变大”、“不变”或“变小”)。
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
=_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:实验题
利用下面装置设计实验,制备SO2并进行探究。

(1)装置A中反应的化学方程式:__________________。
(2)将A中产生的SO2持续通入装置G中直至过量。

①G中有白色沉淀生成,其化学式为_________。
②写出反应初始时SO2被氧化的离子方程式:________________。
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3,能作为依据的实验现象是:________。
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号):A__________________。
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:实验题
锰酸锂(LiMn2O4)可作为锂离子电池的正极材料。工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如下:
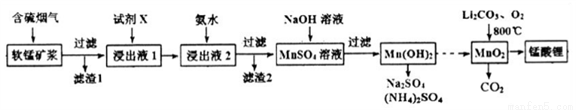
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:

(1)已知:

下列措施可提高SO2吸收率的是__________(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是_____________(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是_______________。
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC  LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
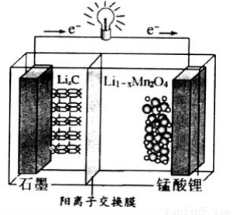
①放电时,电池的正极反应式为__________________
②充电时,若转移1mole-,则石墨电极将增重__________g。
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:填空题
硼及其化合物在工农业生产中应用广泛。
(1)基态硼原子的核外电子排布式为__________,有_______种不同能量的电子。
(2)BF3溶于水后.在一定条件下可转化为H3O+·[B(OH)F3]-,该物质中阳离子的空间构型为_____________,阴离子的中心原子轨道采用________杂化。
(3)与BH4-互为等电子休的分子是_______________(写化学式)。
(4)EminBF4的熔点为12 ℃,在常温下为液体,由有机物阳离子[Emin]+和[BF4]-构成。该物质的晶体属于_________晶体。
(5)一种由硼和钐(Sm)形成的晶体的晶胞结构如图所示,已知晶胞常数a=n pm,则晶体的密度为_____________g·cm-3(设NA为阿伏伽德罗常数的值)。
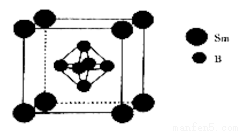
查看答案和解析>>
科目: 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:推断题
双安妥明可用于降低血液中的胆固醇,其结构简式为:
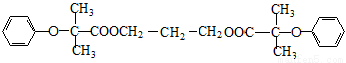
该物质的合成线路如下:

已知:I. 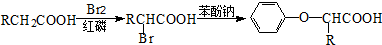
II. RCH═CH2 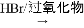 RCH2CH2Br
RCH2CH2Br
III.同温同压下A的密度是H2密度的28倍,且支链有一个甲基;G能发生银镜反应,且1molG能与2molH2发生加成反应。
(1)双安妥明的分子式为___________________。
(2)A的结构简式为___________________。
(3)反应B→C的反应条件是______________,G→H的反应类型是________________。
(4)反应“F+I→双安妥明”的化学方程式为___________________。
(5)符合下列3个条件的F的同分异构体有____________种。条件:①与FeCl3溶液显色;②苯环上只有两个取代基;③1mol该物质最多可与3molNaOH反应。
(6)参照上述合成路线,请设计由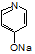 (
(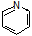 与苯环性质相似)与
与苯环性质相似)与 苯合成
苯合成 的路线______________。
的路线______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com