电解 2Al2O3====4Al+3O2↑
高温 3MnO2+ 4Al == 3Mn+2Al2O3 例4根据下图所示实验室用一氧化碳还原氧化铁的实验装置,回答以下问题:
①反应过程中发生的现象是: 玻璃管里粉末由红棕色逐渐变黑,B中溶液出现浑浊。 ; ②塑料袋的作用是 收集未反应完的CO,以防中毒 。
试题详情

4.实战演练 试题详情
一、选择题? 1.冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是? A.(Ⅰ)用① B.(Ⅱ)用②? C.(Ⅲ)用③ D.(Ⅳ)用④? 试题详情
2.下列物质的反应,不能置换出Fe的是? A.FeO+C B.Fe2O3+CO? C.Al+Fe3O4 D.Cu+FeCl3? 试题详情
3.在高温下,用CO还原m g Fe2O3,得n g Fe,已知氧的相对原子质量为16,则Fe的相对原子质量为 试题详情
A. B. B.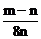 试题详情
C. D. D.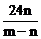 试题详情
4.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入足量澄清石灰水中,得到0.75 g固体沉淀物。这种铁的氧化物的化学式为? A.FeO B.Fe2O3? C.Fe3O4 D.FeO、Fe2O3? 试题详情
5.在炼铁、炼钢过程中都有碳参加反应,下列有关碳参加反应的叙述错误的是? A.两个过程中碳原子都是被氧化,都只起着提供热源的作用? B.炼铁过程中碳被氧化,既起产生热量的作用,又起产生CO的作用? C.炼钢过程中碳被氧化,从而达到降低含碳量的目的? D.炼铁过程中碳参加反应,只起着产生CO的作用? 试题详情
试题详情
A.FeO+Si Fe+SiO2? Fe+SiO2? 试题详情
B.Fe2O3+CO Fe+CO2? Fe+CO2? 试题详情
C.Fe3++Fe Fe2+? Fe2+? 试题详情
D.Cu+H2SO4(浓) CuSO4+SO2↑+H2O? CuSO4+SO2↑+H2O? 试题详情
7.合金具有许多特点,如Na-K合金为液体,而Na和K的单质均为固体。据此,试推测:生铁、纯铁、碳3种物质中,熔点最低的是? A.纯铁 B.生铁? C.碳 D.无法确定? 试题详情
8.我国的稀土矿含量丰富,稀土元素可用RE表示。在提纯过程中可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀,反应为:? 试题详情
RE2(SO4)3+Na2SO4+xH2O RE2(SO4)3?Na2SO4?xH2O(x=1,2)下列有关叙述正确的是 RE2(SO4)3?Na2SO4?xH2O(x=1,2)下列有关叙述正确的是 A.该反应一定在强碱溶液中进行? B.产生沉淀的反应为复分解反应? C.反应生成的沉淀属于复盐? D.产生沉淀的变化属于化学变化? 试题详情
9.下列叙述正确的是? A.含金属元素的离子不一定是阳离子? B.在氧化还原反应中,非金属单质一定是氧化剂? C.某元素从化合态变为游离态时,该元素一定被还原? D.金属阳离子被还原不一定得到金属单质? 试题详情
10.质量相等的CaO2和CaO两份样品,前者与后者所含氯元素的质量比是? A.2∶1 B.7∶9? C.14∶9 D.9∶7? 试题详情
二、非选择题(50分)?
试题详情
FeC2O4 FeO+CO↑+CO2↑? FeO+CO↑+CO2↑? 试说明不采用FeCO3加热分解制FeO而用此法制FeO的原因。? 试题详情
12.(12分)(1996年全国高考题)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol?L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。 填写下列空白:? (1)实验进行时试管A中应加入的试剂是
; 烧瓶B的作用是
; 烧瓶C的作用是
; 在试管D中收集得到的是
。 试题详情
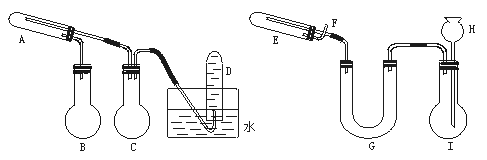
(2)实验时,U型管G中应加入的试剂是
;长颈漏斗H中应加入
。 (3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)
。 (4)烧瓶Ⅰ中发生的反应有时要加入少量硫酸铜溶液,其目的是
。 (5)试管E中发生反应的化学方程式是
。 (6)为了安全,在E管中的反应发生前,在F出口处必须
;E管中的反应开始后,在F出口处应
。 试题详情
13.(12分)下图是一个实验示意图,方框表示有关的仪器,箭头表示液体或气体的流向 试题详情
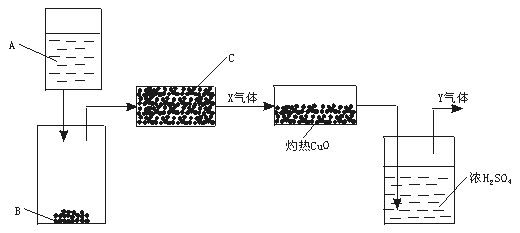
图中A是液体,B、C是固体。A与B反应后产生的气体经过C,得到纯气体X。X通过灼热CuO,CuO转化为Cu。气体再通过浓H2SO4,最后得到纯气体Y,Y是对环境没有污染的气体,大量排放也没有危险。? 为进行以上实验,请从下列试剂范围内选择合适的A、B和C:浓硫酸、稀硫酸、浓硝酸、稀硝酸、浓盐酸、稀盐酸、锌粒、浓NaOH溶液、大理石、碱石灰、NH4Cl固体。? (1)A是
,B是
,C是
,X是
。 (2)写出A和B,X和CuO反应的化学方程式
。 试题详情
14.(8分)为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52 g样品,将其全部溶于过量稀硝酸后,配成100 mL溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66 g固体。在余下的50 mL溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。 (1)计算磁性粉末材料中氧元素的质量分数。? (2)确定该材料的化学式。?????????????? 试题详情
15.(10分)有CuO和木炭粉的混合物4.24 g,在高温条件下充分反应后,剩余固体混合物呈红色,质量为3.36 g;若反应产生的气体能全部被过量的澄清石灰水吸收,得沉淀2 g,试通过计算指出所得固体产物的组成及质量分数。 试题详情
一、1.B 2.D
3.D? 4.解析:FexOy+yCO xFe+yCO2? xFe+yCO2? (56x+16y)
g y mol? 0.4 g  mol mol 得:x∶y=2∶3? 答案:B 5.AD 6.B
7.B 8.CD? 9.解析:A.如AlO B.如C+FeO B.如C+FeO CO↑+Fe C.如Br- CO↑+Fe C.如Br- Br2 D.如Fe3+ Br2 D.如Fe3+ Fe2+ Fe2+ 答案:AD? 10.C? 二、11.FeCO3在空气中加热,因+2价铁被空气氧化而得不到FeO;而FeC2O4分解,产生的CO可作保护气,防止FeO氧化。? 12.(1)普通铁粉(或铁粉) 作为水蒸气发生器(或用来产生水蒸气) 防止水倒吸(或用作安全瓶) 氢气? (2)固体NaOH(或碱石灰、CaO等碱性固体干燥剂) 6摩/升HCl? 注:G中如填写酸性干燥剂或液体干燥剂,则此空不给分。? (3)ABE (必须全对给一分,错、漏一个即不给分)? (4)加快氢气产生的速度? (5)Fe3O4+4H2 3Fe+4H2O? 3Fe+4H2O? (6)检验氢气的纯度 点燃氢气? 13.(1)A.浓NaOH溶液 B.NH4Cl固体 C.碱石灰 X:NH3? (2)NaOH+NH4Cl NaCl+NH3↑+H2O? NaCl+NH3↑+H2O? 2NH3+3CuO 3Cu+N2↑+3H2O? 3Cu+N2↑+3H2O? 14.(1)20.4% (2)BaO?Fe2O3? 15.Cu2O和Cu w(Cu2O)=42.9% w(Cu)=57.1%
| 