
济宁市2008―2009学年度第一学期高三质量检测
化 学 试 题
注:(1)本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
(2)请将第Ⅰ卷选择题答案填涂在答案卡上,考试结束时只交答案卡和第Ⅱ卷。
可能用到的相对原子质量:H:1
O:16 Na:
第Ⅰ卷(选择题 共46分)
一、选择题(本题包括8个小题,每小题2分,共16分。每小题只有一个选项符合题意)
1.在一定条件下,下列物质与硅、二氧化硅均不反应的是
A.氢氟酸 B.浓H2SO
2.下列仪器:①漏斗;②容量瓶;③蒸馏烧瓶;④托盘天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙,其中常用于物质分离的是
A.①③④ B.①③⑤ C.①②⑥ D.①⑤⑦
3.下列现象或应用中,不涉及胶体知识的是
A.清晨,在茂密的树林中,常常可以看到从枝叶间透过的道道光柱
B.用半透膜分离淀粉和食盐的混合液
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
4.下列关于氧化物的叙述正确的是
①酸性氧化物肯定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物都是碱性氧化物
⑤酸性氧化物可与H2O反应生成相应的酸
⑥与H2O反应生成酸的氧化物不一定是酸性氧化物
⑦不能与酸反应的氧化物一定能与碱反应
A.①②③④ B.⑤⑥⑦ C.②③⑥⑦ D.③⑥
5.在给定的四种溶液中,同时加入以下各种离子,可能在该溶液中大量共存的是
A.pH为1的溶液:Ca 、Na
、Na 、Mg
、Mg 、NO3
、NO3
B.滴加石蕊试液显红色的溶液:Fe 、NH4
、NH4 、Cl
、Cl 、SCN
、SCN
C.与铝反应放出氢气的溶液:K 、HCO3
、HCO3 、Br
、Br 、Ba
、Ba
D.所含溶质为FeCl2的溶液:K 、SO4
、SO4 、NO3
、NO3 、H
、H
6.下列说法正确的是
A.由同一种元素形成的物质一定是纯净物
B.元素由游离态转化合态,一定被氧化
C.较活泼金属一定可以把较不活泼的金属从盐溶液中置换出来
D.金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物
7.将过量的气体通入到一种溶液中,一定能产生沉淀的是
①二氧化硫通入到硝酸钡溶液中 ②二氧化碳通入偏铝酸钠溶液中
③二氧化碳通入到氯化钙溶液中 ④氨气通入到AgNO3溶液中
A.只有①②③ B.只有①② C.只有①②④ D.只有②③
8.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1molCl2参加的任何反应,反应过程中转移电子数都是2NA
B.常温常压下的33.
C.标准状况下, ×2
×2
D.将10mL质量分数为98%的浓H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8%
二、选择题(本题包括10个小题,每小题3分,共30分。每小题只有一个选项符合题意)
9.vmL密度为 g?mL
g?mL 的某溶液中,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为W%,物质的量浓度为cmol?L
的某溶液中,含有相对分子质量为M的溶质mg,该溶液中溶质的质量分数为W%,物质的量浓度为cmol?L ,那么下列关系式正确的是
,那么下列关系式正确的是
A.C= B.C=
B.C= C.W%=
C.W%= % D.m=
% D.m=
10.下列反应的离子方程式书写正确的是
A.烧碱溶液和过量Ca(HCO3)2溶液反应:
2OH +Ca
+Ca +2HCO3
+2HCO3 =CaCO3↓+CO3
=CaCO3↓+CO3 +2H2O
+2H2O
B.碳酸钙与醋酸溶液反应:
CaCO3+2H =Ca
=Ca +CO2↑+H2O
+CO2↑+H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:
2Fe +2H
+2H +H2O2=Fe
+H2O2=Fe +2H2O
+2H2O
D.向硫酸铜溶液中滴加氢氧化钡溶液至SO4 恰好沉淀完全:
恰好沉淀完全:
Cu +SO4
+SO4 +2OH
+2OH +Ba
+Ba =Cu(OH)2↓+BaSO4↓
=Cu(OH)2↓+BaSO4↓
11.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强相等 B.两种气体的氧原子数相等
C.O2比O3的质量小 D.两种气体的分子数相等
12.下列各项操作中不发生先沉淀后溶解现象的是
①向饱和Na2CO3溶液中通入过量CO2
②向Fe(OH)3胶体中逐滴滴入过量的H2SO4
③向AgI胶体中逐滴加入过量稀盐酸
④向石灰水中通入过量CO2
⑤向Na2SiO3溶液中滴入过量的盐酸
A.①②③ B.②③⑤ C.①②③⑤ D.①③⑤
13.在反应Cu2S+4H2SO4(浓)===2CuSO4+2SO2↑+S↓+4H2O中,氧化产物与还原产物的物质的量之比为
A.1:2 B.2:
14.有Al、CuO、Fe2O3组成的混合物共10. 的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为
的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为
A.1.00mol?L B.0.500mol?L
B.0.500mol?L C.2.00mol?L
C.2.00mol?L D.3.00mol?L
D.3.00mol?L
15.在100mL含等物质的量的HBr和H2SO3的溶液里通入0.1molCl2,有 的Br
的Br 变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.8.0 mol?L B.1.6 mol?L
B.1.6 mol?L C.0.8 mol?L
C.0.8 mol?L D.16.0 mol?L
D.16.0 mol?L
16.把7.2铁粉投入到某HNO3溶液中,充分反应后剩余固体1.
A.0.34mol B.0.38mol C.0.28moi D.0.2mol
17.下列说法正确的是
A.用乙醇从碘水中萃取单质碘
B.合金的熔点大于它的成分金属
C.电解质溶液在通电的情况下发生电离,产生了自由移动的离子,从而能够导电
D.“
18.由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少一部分。将上述混合物在空气中加热,有气体放出,下列判断正确的是
A.混合物中一定不含有Na2CO3、NaCl B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3 D.混合物中一定不含Na2O2、NaCl
第Ⅱ卷(非选择题 共54分)
三、(本题包括3小题,共27分)
19.(4分)
 化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
(1)在盛放浓硫酸的试剂瓶的标签上印有如右图所示警示标志,说明浓硫酸是一种 。
(2)下列有关实验操作和安全事故处理错误的有 。
a.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
b.用试管夹从试管底由下往上夹住距管口约 处,手持试管夹长柄进行加热
处,手持试管夹长柄进行加热
c.把用氯酸钾制氧气后的残渣倒入垃圾桶
 d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石
d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石
e.配制硫酸溶液时,在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
f.用右图所示装置吸收氨气
20.(5分)按要求填空:
(1)用已经称量好的10. 氢氧化钠溶液250mL,所需要的仪器为量筒和
。(2分)
氢氧化钠溶液250mL,所需要的仪器为量筒和
。(2分)
(2)除去KCl溶液中的SO4 ,依次加入的试剂为(填化学式) 。
,依次加入的试剂为(填化学式) 。
21.(18分)
长期存放的Na2SO3会被空气中的氧气部分氧化:某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。
(Ⅰ)甲同学设计了下图实验

请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应如何检查虚线框内装置的气密性?
(2)写出B装置中的离子方程式 。
写出D装置中反应的化学方程式 。
(3)称量agNa2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaCl2溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀bg,则样品中Na2SO3的质量分数为 。
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
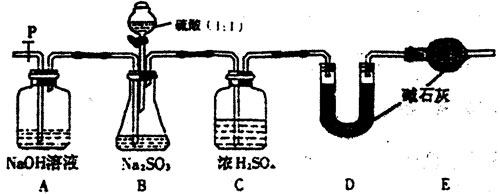
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处,(填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液。
丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数。
下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀mlg
B.将样品溶解,加足量硝酸,再加足量BaCl2溶液、过滤、洗涤、干燥、称量得沉淀m
C.将样品溶解,加过量BaCl2溶液,过滤后将溶液蒸干,称量得固体m
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤,洗涤、干燥,称量得固体m
四、(本题包括2小题,共9分)
22.(5分)
用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化法提纯。其反应式为:
(1)此反应的氧化剂是 ;lmol氧化产物中所含有的共价单键数目为 (阿伏加德罗常数用NA表示)。
(2)H2SO4在上述反应中表现出来的性质是 (填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(3)上述反应中若产生0.2mol CO2气体,则转移电子的个数是 (结果保留2位有效数字)。
23.(4分)
某一无色溶液,可能含有Na 、Cu
、Cu 、NH4
、NH4 、Fe
、Fe 、Al
、Al 、Mg
、Mg 、CO3
、CO3 、SO4
、SO4 、K
、K 等离子中的一种或几种,为确定其组成,做如下实验:
等离子中的一种或几种,为确定其组成,做如下实验:
①取少量待测溶液,向其中滴入盐酸酸化的氯化钡溶液,生成白色沉淀;
②另取少量待测溶液,向其中加入过氧化钠,产生无色无味气体,并生成白色沉淀;加入过量过氧化钠时,沉淀部分溶解。
试判断:溶液中一定存在的离子有 ;一定不存在的离子有 。不确定的是 为验证此离子的存在,还应进行 实验。
 五、(本题包括1小题,共8分)
五、(本题包括1小题,共8分)
24.(8分)
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是 ;其中的B和D在电子工业上有着举足轻重的作用,试分别说出它们的一项重要用途,B ,D 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ,其中检验C溶液中含有A元素离子的操作和现象是 。
六、(本题包括2小题,共l0分)
25.(4分)
Fe和Al是两种常见的金属,将它们按一定的质量比组成混合物。取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准标况下为aL,则反应的化学方程式为 ;混合物中Al的物质的量为 (用含字母的数学式表示)。
26.(6分)
将一块金属钠投入到100mLMgCl3和AlCl3的混合溶液中,发现沉淀先多后少。 反应完毕后收集到13.
则原溶液中Mg 的物质的量浓度为 ;Al
的物质的量浓度为 ;Al 的物质的量浓度为 。
的物质的量浓度为 。
2008 年 高 三 教 学 质 量 检 测化 学 试 题 参 考 答 案
一、每小题2分,共16分。
1.B 2.B 3.D 4.D 5.A 6.D 7.B 8.D
二、每小题3分,共30分
9.A l0.D 11.B 12.D 13.D 14.A 15.B 16.C 17.D 18.B
三、(27分)
19.(4分)
(1)腐蚀性液体
(2)c、e
20.(5分)
(1)烧杯、玻璃棒、250mL容量瓶、胶头滴管(每答对一种0.5分,容量瓶不注明容积不给分,共2分)
(2)BaCl2[或Ba(OH)2]、K2CO3、HCl(3分)
21.(18分)
(1)关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,静置一会观察液面是否变化,若不变,说明气密性良好,否则、说明装置漏气(3个要点全对,得3分,漏一个要点扣1分)
(2)SO2+C12+2H2O===SO4 +
+ +4H
+4H (2分);
(2分);
MnO2+4HCl(浓) MnCl2+C12↑+2H2O(2分)
MnCl2+C12↑+2H2O(2分)
(3) ×100%(2分)
×100%(2分)
(4)锥形瓶及导管中的SO2未全部排入到广口瓶中与Cl2完全反应或由于产生SO2速度较快,未与Cl2反应而排入到NaOH溶液中(2分,其他合理答案也可)
(5)将装置中的SO2全部排入到U形管中被吸收(2分)
(6)D(2分)
(7)A、D(3分,对1个得1分,每漏答、错答、多答1个倒扣1分)
四、(9分)
22.(5分)
(1)K2Cr2O7(或重铬酸钾);4NA
(2)A
(3)4.8×10 (前3个空每空1分,最后1个空2分,共5分)
(前3个空每空1分,最后1个空2分,共5分)
23.(4分)
Al 、Mg
、Mg 、SO4
、SO4 ;NH4
;NH4 、Cu
、Cu 、Fe
、Fe 、CO3
、CO3 (每空1分,错填或漏填皆不得分) K
(每空1分,错填或漏填皆不得分) K 、Na
、Na ;焰色反应
;焰色反应
五、24.(8分)
(1)(4分) Si+2CO↑(2分);光导纤维(或光缆)(1分);半导体材料(或半导体晶体管或蕊片或集成电路)(1分)
Si+2CO↑(2分);光导纤维(或光缆)(1分);半导体材料(或半导体晶体管或蕊片或集成电路)(1分)
(2)(4分)2Fe +C12==2Fe
+C12==2Fe +2Cl
+2Cl (2分);取少许C中的溶液(FeCl2)于试管中,向其中滴加KSCN溶液,溶液不变色,再向其中滴加氯水若溶液变红色,则证明C溶液中含有A元素的离子(Fe
(2分);取少许C中的溶液(FeCl2)于试管中,向其中滴加KSCN溶液,溶液不变色,再向其中滴加氯水若溶液变红色,则证明C溶液中含有A元素的离子(Fe )。(2分)
)。(2分)
六、(10分)
25.(每空2分,共4分)
 mol
mol
26.(每空3分,共6分)1mol?L ;3mol?L
;3mol?L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com