海南省国兴中学、海师附中、嘉积中学、三亚一中
2008―2009学年度高三年级联考试卷
化 学 试 题
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第I卷时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。写在本试卷上无效。
3.回答第II卷时,将答案写在答题卡上。写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1
C 12 N 14 O 16 Na 23 S 32 C1 35.5
第I卷
一、选择题:本题共12小题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。
 1.下列各项表达式正确的是 ( )
1.下列各项表达式正确的是 ( )
试题详情
A.O2-的结构示意图:
B.Na2S的电子式:
C.乙烯的结构简式:C2H4
D.氮分子的结构式:
试题详情
2.物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是 ( )
A.①②③⑤ B.①②⑤ C.②⑤⑥ D.①④⑤⑥
试题详情
3.从下列事实所得出的相应结论正确的是
实验事实
结论
①
SO2的水溶液可以导电
SO2是电解质
②
将燃烧的镁条放入CO2中能继续燃烧
还原性:Mg>C
③
常温下白磷可自燃而氮气须在放电时才与氧气反应
非金属性:P>N
④
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝
该溶液中一定有NH4+
A.③④ B.②④ C.①② D.全部
试题详情
4.用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
试题详情
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
试题详情
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol?L-1的Na2CO3溶液中含有NA个CO32-
试题详情
试题详情
试题详情
B.0.1mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质
C.给pH=12的NaOH溶液通电一段时间后溶液的pH > 12
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
试题详情
6. 2008年夏季奥运会将在我国举行。奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P 3P2O5+5KC1。下列有关该反应的叙述中,正确的是 ( )
A.反应中红磷是氧化剂
B.反应中消耗3molP时,转移电子的物质的量为15mol
C.“火药”中的红磷可以用白磷代替
D.发令时产生的白烟只是KC1固体颗粒
试题详情
7.可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是
A.银氨溶液 B.新制氢氧化铜悬浊液 C.石蕊试液 D.碳酸钠溶液
试题详情
8.下列溶液中,各组离子一定能够大量共存的是 ( )
A.无色溶液中:K+、H+、SO32-、MnO4-
试题详情
B.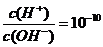 的溶液中:K+、Na+、CO32-、AIO2-
的溶液中:K+、Na+、CO32-、AIO2-
C.能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
试题详情
9.某些化学键键能数据如下:
化学键
H―H
C1―Cl
H―Cl
试题详情
键能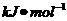
436
243
431
则下列热化学方程式不正确 ( )
试题详情
试题详情
试题详情
试题详情
试题详情
10.下列离子方程式正确的是 ( )
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-===BaSO4↓+NH3?H2O+
H2O
B.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C.钠与水反应:Na+2H2O===Na++2OH-+H2↑
D.碳酸钡中加入稀硫酸:BaCO3+2H+===Ba2++CO2↑+H2O
试题详情
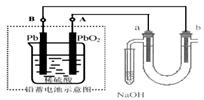 11.用铅蓄电池电解苦卤水
(含C1-、Br-、Na+、Mg2+)
11.用铅蓄电池电解苦卤水
(含C1-、Br-、Na+、Mg2+)
的装置如图所示 (a、b为石墨电极)。下列说法中正
确的是 ( )
A.铅蓄电池放电时,溶液的PH值变小
B.铅蓄电池负极的反应式为:Pb
―2e-+SO42― = PbSO4
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a
电极首先放电的是 H+
试题详情
12.下列各溶液中,微粒的物质的量浓度关系正确
的是
( )
试题详情
A.0.1mol?L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-)
试题详情
B.0.1mol?L-1的NaHCO3溶液中:c(Na+) = c(HCO3-) + c(H2CO3)+
2c(CO32-)
试题详情
C.0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
第Ⅱ卷
本卷包括必考题和选考题两部分。第13题~第17题为必考题,每个试题考生都必须做答。第18题~第29题为选考题,考生根据要求做答。
试题详情
13.(8分)已知A、B、D、E均为中学化学常见单质或化合物,它
试题详情
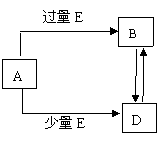 们之间的关系如图所示(部分产物略去)。
们之间的关系如图所示(部分产物略去)。
(1)若A和E为单质,组成A单质的元素是
自然界中形成化合物种类最多的元素。
① B属于
分子(填“极性”或
“非极性”),电子式为 ;
试题详情
②4 g A单质完全燃烧放出131.2 kJ的热
量,写出表示A单质燃烧热的热化学方程
式
;
(2)若A为第三周期中的元素所形成的氯化物。
① 写出A溶液→B的离子方程式 ;
② 写出A和B的溶液反应的离子方程式
试题详情
14.(10分)中学化学中几种常见物质的转化关系如下:
试题详情
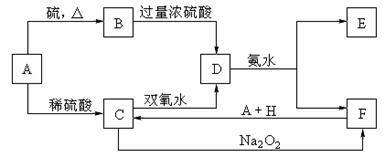
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式
②写出C的酸性溶液与双氧水反应的离子方程式:
。
(4)写出鉴定E中阳离子的实验方法和现象: 。
试题详情
15.(8分) 在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
0.007
(1)写出该反应的平衡常数表达式:K=
。
试题详情
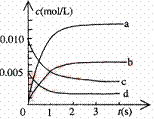
(2)右图中表示NO2的变化的曲线是
。 用O2表示从0~2s内该反应的平均速率v=
。
(3)能说明该反应已达到平衡状态的是
。 a.v(NO2)=2v(O2)
b.容器内压强保持不变 c.v逆 (NO)=2v正 (O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。 a.及时分离除NO2气体
b.适当升高温度 c.增大O2的浓度
d.选择高效催化剂
试题详情
16.(12分).某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。 (1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是____________。 (2)方案二:按下图装置进行实验。并回答以下问题。 试题详情
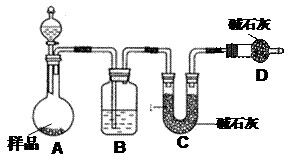
①实验前先_____________________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是______________________________________。 ②实验中除称量样品质量外,还需称__________________装置前后质量的变化。 ③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是
_______________________________________________。 (3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤洗涤,干燥沉淀,称量固体质量,计算: ①过滤操作中,除了烧杯,漏斗外还用到的玻璃仪器有_______________。 ②实验中判断沉淀是否完全的方法是____________________________。 试题详情
③如加入试剂改为氢氧化钡,已知称得样品10.5g,干燥的沉淀质量为19.7g,测样品中碳酸钠的质量分数为____________。 试题详情
17.(10分)烃X是一种重要的化工原料。X能使Br2的四氯化碳溶液褪色,它的密度是同温同压下氢气密度的21倍。由烃X经下列反应可制得A~F等多种有机物。 试题详情

已知:RCH2Br + NaOH → RCH2OH + NaBr (1)烃X的结构简式为
,F的结构简式为
。 (2)由X→A、B→C的反应类型分别为
、
。 (4)B转化为C的化学方程式: ; (4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物G,G的结构简式为:
。 试题详情
以下是选考题,其中第18、19、20、21题为《有机化学基础》模块题,第22、23、24、25题为(物质结构与性质》模块题,第26、27、28、29题为《化学与技术》模块题。考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。 《有机化学基础》模块 18-20为选择题,每小题只有一个正确选项,每小题3分 试题详情
18.分子式为C4H10O并能与金属钠发生反应的物质有 ( ) A.3种 B.4种 C.5种 D.6种 试题详情
19.下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是 ( ) ①CH2=CHCOOH; ②CH2=CHCOOCH3; ③CH2=CHCH2OH; ④CH3CH2CH2OH; ⑤CH3CH(OH)CH2CHO A.①③④ B.②④⑤ C.①②⑤ D.①③⑤ 试题详情
 20.莽草酸是一种合成治疗禽流感药物达菲的 20.莽草酸是一种合成治疗禽流感药物达菲的
原料,鞣酸存在于苹果、生石榴等植物中。 下列关于这两种有机化合物的说法正确的 是
( ) A.两种酸遇三氯化铁溶液都显色 B.鞣酸分子与莽草酸分子相比多了两个碳碳双键 C.中和等物质的量的两种酸所需的氢氧化钠的物质的量相同 D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同 试题详情
21.(10分)已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应: 试题详情
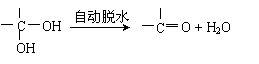
现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应 ( ) 试题详情
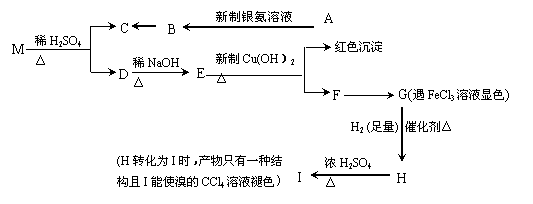
请回答下列问题: (1)G→H的反应类型是 ______ 。 (2)C的结构简式为
__________ ;M的结构简式为 __________ 。 (3)写出下列反应的化学方程式: ①A→ B的化学方程式:
_______
; ②H→I的化学方程式: ___
。 《物质结构与性质》模块 22-24为选择题,每小题只有一个正确选项,每小题3分 试题详情
22.用“等电子原理”可以判断某些分子或离子的空间构型。已知BF3的空间构型为平面三角形。下列分子或离子中,空间构型也为平面三角形的是 ( ) A.NH3 B.CO32- C.PO43- D.SO2 试题详情
23.下列叙述中正确的是 ( ) A.一切四面体空间构型的分子内键角均为109。28, B.Cu(OH)2能溶于过量氨水形成络合物[Cu(NH3)4]2+,中心离子为Cu2+,配位体是 试题详情
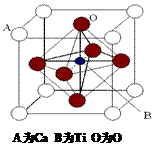
C.任何晶体,若含阳离子也一定含阴离子 D.水分子稳定是因为水分子间存在氢键作用
试题详情
24.某有机物(名称乙烯酮)的结构简式为: CH2=C=O,下列描述正确的是( ) A.该分子中共有2个π健、2个σ健 B.该分子属非极性分子 C.该分子是直线型分子 D.该分子中2个碳原子的杂化方式是不同的 试题详情
25.钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,它的应用研究是目前科学研究的前沿之一。 2007年诺贝尔物理学奖为法国科学家阿尔贝。费尔和德国科学家彼得.格林贝格尔共同获得,以表彰他们在巨磁电阻效应(MR效应)研究方面的成就,某钙钛型复合氧化物(如右图),以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有CMR效应。 (1)写出该晶体的化学式________________ 试题详情
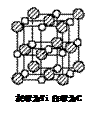 (2)Ti的核外电子排布式为________它位于周期表中________区,价电子排布为________。 (2)Ti的核外电子排布式为________它位于周期表中________区,价电子排布为________。
试题详情
(3)锰的电负性为1.99。Cr的电负性为1.66,说明锰的 金属性比铬_____(强、弱) (4)最近发现钛(Ti)原子和碳原子构成气态团簇分子,分子 模型如图。则其化学式为______。它属于______晶体, 其主要物理性质____________
__________(写出2个即可) 《化学与技术》 26-28为选择题,每小题只有一个正确选项,每小题3分
△ A.无水氯化镁的制备:MgCl2?6H2O MgCl2+6H2O B.生产普通玻璃的主要原料有石灰石、石英和纯碱 C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极 D.漂粉精的制备:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
试题详情
27.在硫酸的工业制法中,下列生产操作及说明生产操作的主要原因二者都正确的是 ( ) A.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧 试题详情
C.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,有利于SO3吸收完全 D.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率 试题详情
28.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是 ( ) A.Fe-2e-=Fe2+
B.2H2O+O2+4e-=4OH- C.2H++2e-=H2↑
D.4OH--4e-=2H2O+O2↑ 试题详情
29.(11分)海南省是海洋大省,海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。 试题详情
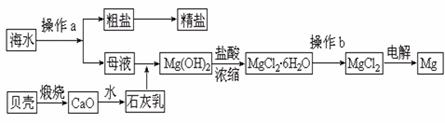
回答下列问题: (1)流程图中操作a的名称为
。 (2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。 ①则气体A应是 (填化学式)其过程反应方程式为_________________________。 ②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是
。 (3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。高考资源网操作b是在
气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式_____________________________________________。 试题详情
(4)一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液________吨,同时消耗______________库电量(1电子电量1.60×10-19C) 试题详情
第I卷 一、选择题 题号 1 2 3 4 5 6 7 8 9 10 11 12 答案 A B B C C B B B A B D 13.(8分) (1)①非极性 二氧化碳电子式略。 (各1分) ② C(s) + O2(g) = CO2(g) △H = -393.6kJ/mol 2分 (2) ① Al3+ + 4OH- =
AlO2- + 2H2O
2分 ② Al3+
+ 3AlO2- + 6H2O = 4Al(OH)3↓ 2分 14.(10分) (1)1nm~100nm(1分)
(2)Fe FeS H2SO4(稀)(3分)
(3)①H H(1分) H(1分)
②2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(4)取少量E于试管中,用胶头滴管入NaOH溶液,加热试管,可观察到试管口处 湿润的红色石蕊试纸变蓝。(或其他合理答案)(3分) 15.(8分) (1)K= (2分) 放热
(1分) (2)b (1分) 1.5×10-3mol?L-1?s-1 (2分) (3)bc (1分) (4)c (1分) 16.(10分) 方案一 (1)
保证NaHCO3全部分解 (1分) 方案二 (2)①检查装置的气密性(1分) 硫酸
(1分) 防止空气中水蒸气、CO2进入C管被吸收(1分) ② C (1分) ③需设计一将A、B中的CO2全部吹入C中吸收的气体装置(1分) 方案三 (3)①玻璃棒(1分) ②取少量滤液,再滴加BaCl2少许,如无白色沉淀说明沉淀完全(1分) ③ 51%(2分) 17.(18分) (1)加成反应 (还原反应)(1分); (2) CH3COOH 1分  Br2CH― ―OOCCH3 ;
2分 Br2CH― ―OOCCH3 ;
2分
△ 
2分 ②
21.(10分) (1)加成反应 (还原反应)(2分);  (2)Br2CH―
―OOCCH3 ; CH3COOH (4分,各2分); (2)Br2CH―
―OOCCH3 ; CH3COOH (4分,各2分);
|
|
△   (3) ①CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O; (3) ①CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O;
②
(4分,各2分) 25.(11分) (1)CaTiO3((2分) (2)1S22S22P63S23P63d24S2或[Ar]
3d24S2
2分 d区 3d24S2 (各1分) (3)弱 1分 (4)Ti14C13 分子 熔点低、沸点低、硬度小(写出2个即可) (各1分) 29.答案.(1)蒸发结晶(或蒸发1分)
1,3,5 NaCl+NH3+H2O+CO2===NaHCO3+NH4Cl(或NH3+CO2+H2O===NH4HCO3
、NH4HCO3+NaCl===NaHCO3+NH4Cl)(1分) ②增加NH4+的浓度,有利于沉淀平衡向生成NH4Cl的方向进行,将NaHCO3转化为Na2CO3而不析出。(1分) (3)①HCl(或氯化氢)(1分) MgCl2?6H2O Mg(OH)Cl + HCl↑+5H2O(1分)
Mg(OH)Cl + HCl↑+5H2O(1分) (4)500 ; 3.8×1011C(各1分,共2分)
| | | | | | | | | | | |

 1.下列各项表达式正确的是 ( )
1.下列各项表达式正确的是 ( )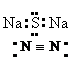
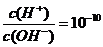 的溶液中:K+、Na+、CO32-、AIO2-
的溶液中:K+、Na+、CO32-、AIO2- 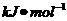
 H2(g)+
H2(g)+ 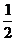 Cl2(g)
Cl2(g) HCl(g);
HCl(g); = -91.5
= -91.5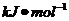
 2HCl(g);
2HCl(g); = -183
= -183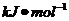
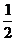 H2(g)+
H2(g)+ 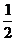 Cl2(g)
Cl2(g) HCl(g);
HCl(g); = +91.5
= +91.5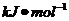
 H2(g)+ Cl2(g);
H2(g)+ Cl2(g); = +183
= +183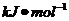
 11.用铅蓄电池电解苦卤水
(含C1-、Br-、Na+、Mg2+)
11.用铅蓄电池电解苦卤水
(含C1-、Br-、Na+、Mg2+) 们之间的关系如图所示(部分产物略去)。
们之间的关系如图所示(部分产物略去)。
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: