
题目列表(包括答案和解析)
(二)(9分)下面是某同学画的自然界中氮元素以蛋白质形式在生物体内转化的部分过程示意图。请根据此图回答下列问题:
|
↓↑

↓↑
|
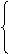
|
|
|
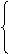 →
→
→ →④
→
→
→ →④
|



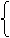 不含氮部分 糖类
不含氮部分 糖类
 ↓↑
转化 脂肪
↓↑
转化 脂肪
|
|
 ↓ ↓ ↓ ↓
↓ ↓ ↓ ↓
 ①具收缩 酶 血浆
②运输氧 新的氯基酸
①具收缩 酶 血浆
②运输氧 新的氯基酸
特性的蛋白质 蛋白 的蛋白质
(1)能将N2转化为NH3的一类生物叫 ① ,这种固氮方式叫 ② 。
(2)自然界中将NH3转化为NO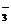 的生物叫 ③
,该种生物的同化作用代谢类型是 ④ 。
的生物叫 ③
,该种生物的同化作用代谢类型是 ④ 。
(3)图中标号不可能发生的是 ⑤ ,植物的根从土壤中吸收的NO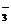 与 ⑥
有机物
与 ⑥
有机物
合成为植物蛋白质。
(4)动物通过⑤取得氨基酸需要经过蛋白酶和 ⑦ 两类酶的催化,植物吸收③的方式中需要 ⑧ 。
(5)④形成的场所是 ⑨ 。
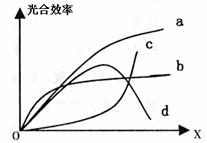
(一)(8分)对绿色植物光合作用的影响因素
是多方面的,其外界因素有光照强度、CO2含
量、温度等,其内部因素有酶的活性、色素的
数量、五碳化合物的含量等,请根据下列影响
光合作用的因素分析:
(1)如果X代表光照强度,光照强度影响光合作
用速率,主要是影响 ① 阶段,其最高限制因素最可能是 ② 。若阴生植物的光合作用曲线为b,则阳生植物的光合作用曲线最可能的是 ③ 。
(2)如果X代表温度,温度主要通过影响 ④ 来影响光合作用速率,可用图中曲线 ⑤
表示。
(3)如果X代表CO2的含量,CO2的含量影响光合作用主要是影响 ⑥ 产生,其最高限制因素可能是 ⑦ 。显微镜下观察某植物叶的横切片,发现维管束鞘细胞内含叶绿体,由此可以判断出某植物的光合作用的曲线最可能的是 ⑧ 。
14.一辆汽车保持功率不变驶上一斜坡,其牵引力逐渐增大,阻力保持不变,则在汽车驶上斜坡的过程中,以下说法正确的是
A.加速度逐渐增大 B.速度逐渐增大
C.加速度逐渐减小 D.速度逐渐减小
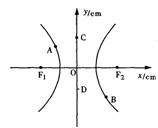 15.如图所示,在双曲线
15.如图所示,在双曲线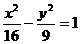 的两个焦点F1和F2上放置两个频率相同的波源,它们激起的波的波长为4cm。就图中A、B、C、D四个质点的振动,下面说法中正确的是
的两个焦点F1和F2上放置两个频率相同的波源,它们激起的波的波长为4cm。就图中A、B、C、D四个质点的振动,下面说法中正确的是
A.若A、B振动加强,则C、D振动一定减弱
B.若A、B振动加强,则C、D一定振动加强
C.A、B、C、D一定振动加强
D.A、B、C、D一定振动减弱
16.美国科研人员正在研制一种新型镍铜长效电池,它是采用半衰期长达100年的放射性同位素镍63(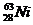 )和铜两种金属作为长寿命电池的材料,利用镍63发生β衰变时释放电子给铜片,把镍63和铜片做电池两极外接负载为负载提供电能。下面有关该电池的说法正确的是
)和铜两种金属作为长寿命电池的材料,利用镍63发生β衰变时释放电子给铜片,把镍63和铜片做电池两极外接负载为负载提供电能。下面有关该电池的说法正确的是
A.β衰变所释放的电子是原子核内的中子转化成质子和电子所产生的
B.镍63的衰变方程是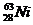 →
→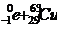
C.提高温度,增大压强可以改变镍63的半衰期
D.该电池内部电流方向是从镍到铜片
17.一质量为M、倾角θ为的斜面体在水平地面上,质量为m的小木块(可视为质点)放在斜面上,现用一平行于斜面的、大小恒定的拉力F作用于小木块,拉力在斜面所在的平面内绕小木块旋转一周的过程中,斜面体和木块始终保持静止状态,下列说法中正确的是
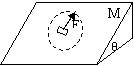 A.小木块受到斜面的最大摩擦力为
A.小木块受到斜面的最大摩擦力为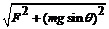
B.小木块受到斜面的最大摩擦力为F-mgsinθ
C.斜面体受到斜面的最大摩擦力为F
D.斜面体受到斜面的最大摩擦力为Fcosθ
18.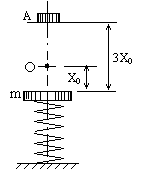 如图所示,质量为m的钢板B与直立的轻弹簧连接,弹簧的下端固定在水平地面上,平衡时弹簧的压缩量X0,另一个表面涂有油泥,质量也为m的物块A,从距钢板3X0高处自由落下,与钢板碰后A、B粘合在一起向下压缩弹簧,则
如图所示,质量为m的钢板B与直立的轻弹簧连接,弹簧的下端固定在水平地面上,平衡时弹簧的压缩量X0,另一个表面涂有油泥,质量也为m的物块A,从距钢板3X0高处自由落下,与钢板碰后A、B粘合在一起向下压缩弹簧,则
A.A、B粘合后的最大速度是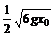
B.A、B粘合后的最大速度大于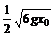
C.在压缩弹簧过程中,A、B组成的系统机械能守恒
D.从A开始运动到压缩弹簧最短的整个过程中,A、B和弹簧组成的系统
机械能不守恒
19.一颗人造地球卫星以速度V发射后,可绕地球做匀速圆周运动,若使发射速度变为2V,则该卫星可能
A.绕地球做匀速圆周运动,周期变大;
B.绕地球运动,轨道变为椭圆
C.不绕地球运动,成为绕太阳运动的人造卫星
D.挣脱太阳引力的束缚,飞到太阳系以外的宇宙
20.子弹在射入木板前动能为E1,动量大小为P1;射穿木板后子弹的动能为E2,动量大小为P2;若木板对子弹的阻力大小恒定,则子弹在射穿木板过程中的平均速度大小为
A.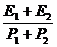 B.
B.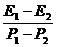 C.
C.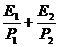 D.
D.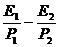
21.人眼对绿光最为敏感。正常人的眼睛接收到波长为530nm的绿光时,只要每秒有6个绿光的光子射入瞳孔,眼睛就能察觉。普朗克常量为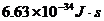 ,光速为
,光速为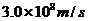 ,则人眼能察觉到绿光时所接收到的最小功率是
,则人眼能察觉到绿光时所接收到的最小功率是
A. 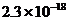 W B.
W B. 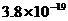 W C.
W C. 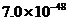 W D.
W D. 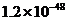
机密★启用前 [考试时间:10月6日 9:00-11:30]
云南师大附中2008届高三第一次教学质量检测
理科综合能力测试
第Ⅱ卷(非选择题,共174分)
第Ⅱ卷共7页,10题,考生务必用黑色碳素笔将答案答在答题卡上.答在试卷上的答案无效.
22.(12分)现有一块59C2型的小量程电流表G(表头),满偏电流为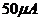 ,内阻约为
,内阻约为
800-850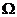 ,把它改装成
,把它改装成 、
、 的两量程电流表。
的两量程电流表。
可供选择的器材有:
滑动变阻器R1,最大阻值20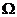 ; 滑动变阻器
; 滑动变阻器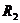 ,最大阻值
,最大阻值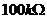
电阻箱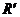 ,最大阻值
,最大阻值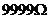 定值电阻
定值电阻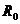 ,阻值
,阻值 ;
;
电池E1,电动势1.5V;电池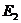 ,电动势
,电动势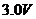 ;电池
;电池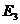 ,电动势
,电动势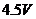 ;(所有电池内阻均不计),标准电流表A,满偏电流
;(所有电池内阻均不计),标准电流表A,满偏电流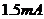 ;单刀单掷开关
;单刀单掷开关 和
和 ,单刀双掷开关
,单刀双掷开关 ,电阻丝及导线若干。
,电阻丝及导线若干。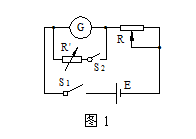
(1)采用如图1所示电路测量表头的内阻,为提高测量精确度,选用的滑动变阻器为 ;选用的电池为 。
(2)将G改装成两量程电流表。现有两种备选电路,示于图2和图3。图 为合理电路,另一电路不合理的理由是 。
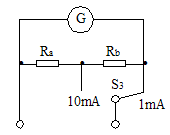
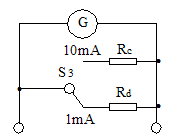
图2 图3
(3)将改装后的电流表与标准电流表逐格进行核对(仅核对1mA量程),画出所用电路图,图中待核对的电流表符号用 来表示。
来表示。
23.(15分)
从水平地面上以初速度v0把小球竖直向上抛出,若小球运动中所受空气阻力是其重力的0.6倍,每次接触地面后在极短的时间内以原速率反弹,重力加速度为g求:
(1)小球从开始抛出到刚刚静止所通过的路程.
(2)小球从开始抛出到刚刚静止所经历的时间.
(提示:若0<q<1,当n无穷大时,取qn=0)
24.(18分)
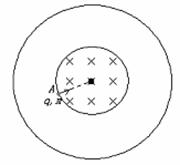 如图所示:为两个共轴金属圆筒,轴线与纸面垂直,内筒半径为R,筒壁为网状(带电粒子可无阻挡地穿过网格)。当两圆筒之间加上一定电压后,在两圆筒间的空间可形成沿半径方向的电场。内圆筒包围的空间存在一沿圆筒轴线方向的匀强磁场,磁场的磁感应强度的大小为B,方向指向纸内。一束质量为m、电量为q的带正电的粒子以各种不同的速率自内圆筒壁上的A点沿内圆筒半径射入磁场,现要求有的粒子的运动能满足下面三个条件:①刚刚能到达外筒的内壁而不与外筒相碰;②粒子恰能从A点射出磁场;③每个粒子在磁场区域内运动所经过的总时间等于该粒子在所给磁场中做完整的圆周运动时的周期的一半。
如图所示:为两个共轴金属圆筒,轴线与纸面垂直,内筒半径为R,筒壁为网状(带电粒子可无阻挡地穿过网格)。当两圆筒之间加上一定电压后,在两圆筒间的空间可形成沿半径方向的电场。内圆筒包围的空间存在一沿圆筒轴线方向的匀强磁场,磁场的磁感应强度的大小为B,方向指向纸内。一束质量为m、电量为q的带正电的粒子以各种不同的速率自内圆筒壁上的A点沿内圆筒半径射入磁场,现要求有的粒子的运动能满足下面三个条件:①刚刚能到达外筒的内壁而不与外筒相碰;②粒子恰能从A点射出磁场;③每个粒子在磁场区域内运动所经过的总时间等于该粒子在所给磁场中做完整的圆周运动时的周期的一半。
(1)为了能满足上述要求,内、外筒间电压的可能值应是多少?
(2)讨论上述电压取最小值时,粒子在磁场中的运动情况。
25.(20分)
在光滑绝缘的水平台面上,存在平行于水平面向右的匀强电场,电场强度为E。水平台面上放置两个静止的小球A和B(均可看作质点),两小球质量均为m,A球带电荷量为+Q,B球不带电,A、B连线与电场线平行。开始时两球相距L,在电场力作用下,A球开始运动(此时为计时零点,即t=0),后与B球发生对心碰撞,碰撞过程中A、B两球总动能无损失。设在各次碰撞过程中,A、B两球间无电量转移,且不考虑两球碰撞时间及两球间的万有引力。
(1)第一次碰撞结束瞬间A、B两球的速度各为多大?
(2)分别在甲、乙坐标系中,用实线作出A、B两球从计时零点到即将发生第三次碰撞这段过程中的v-t图像。要求写出必要的演算推理过程。(图见答题卡)
(3)从计时零点到即将发生第三次碰撞这段过程中电场力共做了多少功?
 (4)若要求A在运动过程中对桌面始终无压力且刚好不离开水平桌面(v=0时刻除外),可以在水平面内加一与电场正交的磁场。请写出磁场
(4)若要求A在运动过程中对桌面始终无压力且刚好不离开水平桌面(v=0时刻除外),可以在水平面内加一与电场正交的磁场。请写出磁场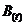 与时间t的函数关系。 (不考虑相对论效应)
与时间t的函数关系。 (不考虑相对论效应)
26.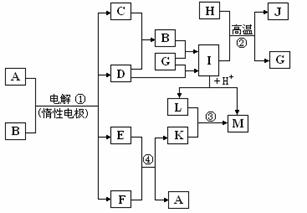 (18分)
(18分)
A、B、C、D、E、F、G、H、I、J、K、L、M等为中学化学常见的物质,其中C、D为非金属单质,F、G、H为金属单质,A的稀溶液呈蓝色,常温下B为无色、无味的液体,K是一种污染大气的气体。物质之间的转化关系如下图所示,部分反应物、产物及反应条件未标出。
(1)I的化学式为 ,通过反应 ②制备1mol G转移的电子的物质的量为 ;
(2)若F和E的稀溶液在加热的条件下也不反应,则下列由F制备A的溶液的方法中,符合绿色化学理念的是 ;
①向E的热稀溶液中加入适量的F和D,至反应完全
②将适量的F和E的浓溶液在加热的条件下反应至完全
③在适量的E的稀溶液中加入适量F和L,或者加入F和M后通入足量空气,反应完全后,调节溶液的pH到3~4,产生沉淀后过滤,滤渣以合理的方式循环使用
④在适量的E的稀溶液中加入适量的F和10%的H2O2溶液后,控制温度在50℃~60℃至反应完全
(3)若F和E的稀溶液在不加热的条件下也能反应,则将F和E的浓溶液在常温下剧烈反应生成的K通入到L的溶液中,发生的反应的离子方程式为 。
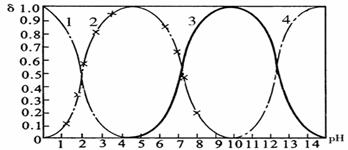 (4)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
(4)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
1表示H3PO4;2表示H2PO4-;3表示HPO42-;4表示PO43-
1)设磷酸总浓度为c(总),写出c(总)与各含磷粒子浓度间的关系式
。
2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是 。
3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是
。
4)在Na3PO4溶液中,c(Na+)/ c(PO43-) 3(填“>”、“==”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/ c(PO43-)的值减小,原因是 。
27.(14分)已知:
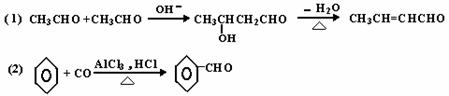
下列有机化合物A~H有如图的转化关系:
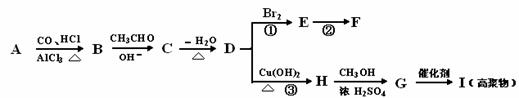
化合物D的分子式为C10H10O,其苯环上的一氯代物只有两种;F的分子式为C10H9OBr。请回答下列问题:
(1)写出下列化合物的结构简式:
A I
(2)反应①的反应类型为 ,反应②的条件为 。
(3)反应③的化学方程式为:
(4)化合物D有多种同分异构体,其中属于酚类,结构中除苯环外无其他环且苯环上只有两种互为对位的取代基的同分异构体有 种(不考虑两双键直接相连)。
(5)以苯、丙醛为原料,其他无机试剂任选,写出制备化合物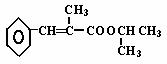 的合理流程图,注明试剂和条件。
的合理流程图,注明试剂和条件。
例:以乙烯制乙二醇的流程图如下:
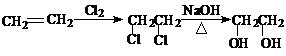
28.(16分)现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后全部投入含b molHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO。试回答下列问题:
(1)用微粒符号填写下列空格(列举出全部可能的情况)
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
残留固体成分 |
|
|
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示);
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等,在标准状况下共产生672mL 气体。求a、b的值。
29.(15分)
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
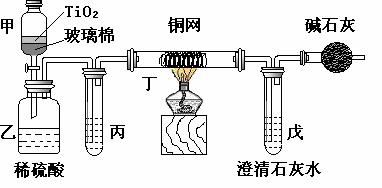
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴甲中反应的离子方程式为
乙中反应的离子方程式为
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是 (填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
⑶丁在实验中的作用是
装有碱石灰的干燥管的作用是
⑷戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。
请说明该测得值与实际处理的百分率相比偏高还是偏低 ?简要说明可能的原因 。
⑸请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂)
 30.(27分)
30.(27分)
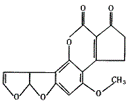
13.黄曲霉素AFTB(右图所示)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,有引发肝癌的可能性,关于黄曲霉素的说法正确的是
A.该化合物的分子式为C16H12O6
B.该化合物水解可生成醇类化合物
C.跟1 mol该化合物反应的H2和NaOH的最大值分别是6 mol和2 mol
D.该化合物所有原子可能在同一平面上
12.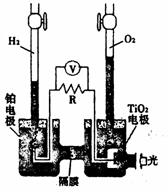 TiO2在光照射下可使水分解:2H2O
TiO2在光照射下可使水分解:2H2O 2H2↑+O2↑,该过程类似植物的光合作用。右图是光照射下TiO2分解水的装
2H2↑+O2↑,该过程类似植物的光合作用。右图是光照射下TiO2分解水的装
置示意图。下列叙述正确的是
A.该装置可以将光能转化为,同时也能转化为电能化学能
B.该装置工作时,电流由TiO2电极经R流向铂电极铂电
C.极上发生的反应为:2H++2e-=H2↑
D.该装置工作时,TiO2电极附近溶液的pH变大
11.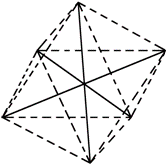 已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被Cl-和H2O取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)几种
已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被Cl-和H2O取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)几种
A.3种 B. 4种 C.5种 D. 6种
10.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
A.H2 B.CO C.C6H12O6 D.C12H22O11
9. 下列说法中不正确的是
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
8. 下列有关实验中,用所选用的试剂(括号内物质)不能达到目的的是
A.检验Na2SO4溶液中是否混有NaCl(AgNO3溶液)
B.证明FeCl2溶液被氧化(KSCN溶液)
C.除去C2H2气体中的H2S气体(CuSO4溶液)
D.鉴别SO2和CO2两种气体(溴水)
7.下列反应的离子方程式书写正确的是
A.用氨水吸收少量SO2气体,2NH3·H2O+SO2=2NH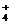 +SO
+SO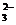 + H2O
+ H2O
B.向FeI2溶液中通入Cl2至Fe2+恰好完全被氧化,2Fe2++Cl2=2 Fe3++2Cl-
|
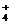 +OH-
+OH-D.Cl2通入水中,Cl2+ H2O=2H++ Cl-+ ClO-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com