
题目列表(包括答案和解析)
10、已知:在10mL盐酸、氯化铝和氯化铁的混合溶液中,各阳离子的物质的量浓度相等,氯离子的物质的量浓度为7mol/L,向此溶液中加入1mol/L的NaOH溶液,至沉淀质量不再变化,此时所需NaOH溶液的体积为( )
A、70mL B、80mL C、50mL D、40mL
9、在以下给定的四种溶液中,加入后面的四种离子,各离子一定能在给定溶液中大量共存的是( )
A、c(H+)<c(OH-)的溶液中:S2- SO32- K+ Na+
B、含大量Fe3+的溶液中:NH4+ OH- SO42- Br-
C、与Al反应放出H2的溶液中:Mg2+ K+ HCO3- NO3-
D、pH=1的溶液中:Fe2+ NO3- I- Na+
8、社NA为阿伏加德罗常数,下列有关叙述正确的是( )
A、标准状况下,11.2L三氧化硫中含有的分子数为0.5NA
B、常温常压下,铁与稀盐酸反应放出2gH2时,转移的电子数为2 NA
C、7.8gNa2O2晶体中含有的阴离子数为0.5 NA
D、18g重水(D2O)中含有的电子数为10 NA
7、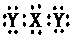 X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z,实验测知,Z晶体具有较高的熔点和沸点,则下列说法正确的是( )
X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z,实验测知,Z晶体具有较高的熔点和沸点,则下列说法正确的是( )
A、固体Z与干冰属于同一晶体类型 B、化合物Z的电子式为:
C、化合物Z在熔融状态下可以导电 D、化合物Z的化学式为:YX2
6、我市是中国西部化工城,当前,贯彻党的十七大精神、推进“节能减排”工作,促使化工企业可持续发展具有极为重要的意义。下列叙述与“节能减排”不相符的是( )
A、我市盛产煤,在调整能源结构中,应加大燃煤在能源结构中的比率
B、化工生产中,严格治理三废(废水、废气、废渣),并尽可能把“三废”变废为宝
C、硫酸生产过程中,在沸腾炉旁设置“废热”锅炉,产生蒸气来发电
D、大力发展洁净煤技术,将煤液化、气化处理后,用于工业生产和日常生活
2、实验结果预测及结论:
31. ( 18 分)植物生命活动调节的基本形式是激素调节。下表是植物不同部位各种激素的相对浓度,请分析回答

(l)植物激素对植物的生长发育产生显著的调节作用,植物的生长发育是由多种激素相互协调、共同调节的。目前公认的植物激素共有五大类,除上表格中的四类外,植物体内还有_ 属于植物激素,该激素的主要作用是_
(2)比较茎尖和伸长茎各激素的含量,同时从细胞学基础来分析植物的生长,可以说明生长素和赤霉素主要是通过促进 而促进生长,细胞分裂素主要是通过促进 而促进生长。
( 3 )分析上表可知幼叶中没有脱落酸,成熟叶含有较多的脱落酸。某同学通过查资料得知“成熟叶叶柄容易脱落是因为成熟叶含有脱落酸,而脱落酸能促进叶柄脱落”。请你设计一个实验验证这句话。
l 、实验步骤:
第一步:选取同一品种、生长状况良好且大小相同的植物三棵,分别标记为甲、乙、丙。
第二步:
第三步:
30.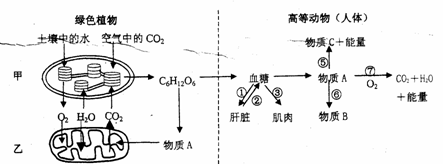 ( 24 分)下图为植物和高等动物(如人体)新陈代谢的部分过程示意图分析回答
( 24 分)下图为植物和高等动物(如人体)新陈代谢的部分过程示意图分析回答
(l)在植物的叶肉细胞中,甲、乙两种细胞器都是重要的“能量转换器”且两种结构的膜面积都很大,其中甲增加膜面积是通过 ,乙增加膜面积是通过 .
(2)请写出发生在甲结构中的总反应式 ;在高温干旱的环境里,绿色植物从空气中吸收的CO2 会减少,原因是 ,若该植物为玉米,此种环境对其光合作用的影响并不是很大,原因是_
(3)绿色植物通过甲所产生的糖类,由消化道进入人体并被组织细胞所利用,整个过程共穿过_层磷脂双分子层·
(4)发生在高等动物细胞结构乙中的生理过程是(填序号) ;在缺氧情况下,物质A 可通过⑤ 过程形成物质C(填名称) ,其去路主要为 ;物质A 在肝脏内可以在谷丙转氨酶的作用下进作用,形成物质B(填名称)
(5)在饥饿的情况下,作用② 过程会加强,分泌加强的激素
29. (12 分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用基于下列反应的方法治理:2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
NO + NO2 + 2NaOH 2NaNO2 + H2O;
⑴ 若在标准状况下有NO、NO2的混合物恰好与50mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
⑵ 设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离。
① NOx与NaOH溶液反应的化学方程式:
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,求所得利润y(出售价减去成本价,单位:万元)与x的关系式。
27.(15 分)在容积相同的不同容器中,分别充入等量的按体积比1 : 1 混合的的N2和H2 ,在不同温度下发生反应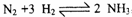 ,并在第10S时分别测定其中NH3的体积分数并绘成如图十七所示曲线.
,并在第10S时分别测定其中NH3的体积分数并绘成如图十七所示曲线.
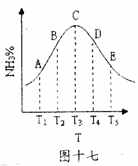 (1) A 、B 、C 、D 、E 五点中,尚未达到化学平衡的点是___________________
(1) A 、B 、C 、D 、E 五点中,尚未达到化学平衡的点是___________________
(2)该可逆反应的正反应是 (填“吸热”或“放热” )反应。
(3)由T1 ,向T2 变化时,V正___v 逆,(填“>”、“〈”或“=” 〉; 由T3 ,向T4 变化时,V正______v 逆
(4)已知E 点对应的纵坐标为20 % , 点E混合气体的平均相对分子质量是 _____________
28 ( l5 分)根据下图十八所示关系填空,己知所有字母表示的是纯净物或水溶液,反应① 、③ 是工业生产中的重要反应,D 、E 常温下为气休,x 常温下为无色液体,H 与E 相对分子质量之间的关系为Mr(H)- Mr(E) = 34 ,又知C焰色反应火焰呈黄色.
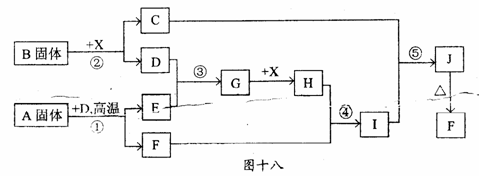
( l ) B 固体中所包含的化学键有
( 2 )反应① 的化学方程式为 ;反应⑤ 的离子方程式为
( 3 )工业上反应③ 的条件为
( 4 )在工业上G 是如何转化为H 的?(请用文字叙述)
_____________________________________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com