
题目列表(包括答案和解析)
27.(14分)A是一种盐,它能发生如下图所示的转化(某些次要的生成物均已略去)。其中B是红棕色固体,I是不溶于稀盐酸的白色沉淀,J是不溶于稀硝酸的浅黄色沉淀。
  B B |
 ②CO ②CO |
F |
 ⑤ ⑤ |
A溶液 |
|
A固体 |
 △ △ |
C |
 ③H2O ③H2O |
E |
 ⑥ ⑥ |
I |
① 某强碱溶液
 D D |
 ④ ④ |
H |
 ⑦AgNO3溶液 ⑦AgNO3溶液 |
J |
某卤素单质的水溶液
(1)写出A、C、F、I的化学式:
A______________,C________________,F_______________,I__________________
(2)写出反应④的离子方程式:____________________________________________
(3)工业上用水、氧气和黄铁矿作用制取A,同时得到E,写出此反应的化学方程式:
26.(12分)X、Y、Z、W、M五种元素中有四种短周期主族元素。
①四种短周期元素中有两种元素在同一主族。
②X的核电荷数比Y少2个。
③五种元素中M的原子序数最小,且核外电子层数和其它元素核外电子层数都不同。
④五种元素中有两种元素可以形成AB型、A2B3型、A3B4型等多种化合物。
⑤X和Y可以形成YY、XY2等化合物。
⑥Z和W可以形成WZ、WZ2等化合物。
请回答:
(1)④中AB型、A2B3型、A3B4型化合物的化学式是______、______、______。
(2)甲、乙、丙三种常见的可燃气体是由这五种元素中的一种或多种元素组成的。甲、乙、丙燃烧时都发出蓝色或淡蓝色火焰,甲、乙、丙的化学式是_______、________、________。
(3)很多反应都可以生成M单质,请再写出一个生成M单质反应的化学方程式。(要求:参加反应的物质由五种元素中的一种或多种元素组成;反应条件不同于实验室制取M单质的反应条件)___________________________________________________。
(4)已知WZ2可以在高温条件下和空气中的氧气反应,1 mol WZ2充分反应,放出853 kJ的热量。该反应的热化学方程式是_________________________________。
13.若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是: Cu+2H+=Cu2++H2↑,则关于该装置的有关说法正确的是:
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,电解质溶液不可能是盐酸
D.该装置只能是电解池,且金属铜为该电解池的阳极
12.
 有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH2)溶液、
有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH2)溶液、
Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均
为0.2mol·L-1)。为了鉴别以上物质,操作如下:各取少量溶液
进行两两混合,实验现象如表1所示,表中“↓”表示生成沉淀
或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现
象。下列说法正确的是 ( )
A.a是稀硫酸 B.b可能是Na2CO3溶液
C.c是Ba(OH、)2溶液 D.d是MgCl2溶液
11.乙酸橙花酯是一种食用香料,结构如图所示。下列关于该有机物的说法有如下几种:
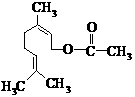 ①该有机物有一种同分异构体属于酚类;
①该有机物有一种同分异构体属于酚类;
②该有机物属于酯类;
③该有机物不能发生银镜反应;
④该有机物的分子式为C11H18O2;
⑤1mol该有机物最多能与2mol NaOH反应。
其中正确的是
A.①③④ B.②③ C.①④⑤ D.①③⑤
10.常温下,下列溶液中各离子浓度关系正确的是
A.浓度为0.01mol/L的FeCl3溶液: c(Cl-)=3c(Fe3+)
B.浓度为0.1mol/L的碳酸钠溶液: c(Na+)+c(H+)=2c(CO32-)+c(OH-)
C.pH=12的氨水溶液与pH=2的盐酸等体积混合: c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.醋酸溶液与NaOH溶液相混后,所得溶液呈中性: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
9.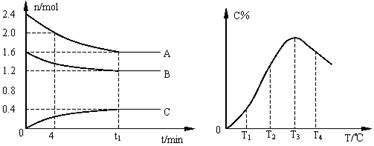 在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系。某温度下,A、B、C三者物质的量与时间的关系如下左图所示,而C的百分含量与温度的关系如下右图所示。
在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系。某温度下,A、B、C三者物质的量与时间的关系如下左图所示,而C的百分含量与温度的关系如下右图所示。
下列说法错误的是:
A.0-4分钟时,A的平均反应速率为0.01mol/(L·min)
B.由T1向T2变化时,V正>V逆
C.此反应的正反应为吸热反应
D.其它条件不变时给平衡体系加压,达新平衡时,C的体积分数增大
8.下列离子方程式书写正确的是
A.氧化铜与稀硫酸:O2-+2H+=H2O
B.碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
C.Fe3O4溶于过量的稀HNO3:Fe3O4+8H+=2Fe3++Fe2++4H2O
D.少量的NaHCO3溶液与过量的Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
7.下列说法中正确的是(NA表示阿伏加德罗常数的值)
A.SiO2晶体中,1 mol硅原子与氧原子形成的共价键数是2NA
B.标准状况下,1 L己烷所含碳原子个数约为6NA/22.4
C.3.2 g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA
D.常温常压下,0.1 mol氖气含有的电子数为NA
29、(1)①当a=7时HnB为强酸,当a>7时HnB为弱酸(2分)
②Bnˉ+H2O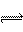 HB(nˉ1)ˉ+OHˉ(2分)
HB(nˉ1)ˉ+OHˉ(2分)
③c(Na+)>c(Bˉ)>c(OHˉ)>c(H+)(2分) 10ˉ10 mol·Lˉ1(2分)
④11(2分)
(2)Ksp=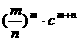 (2分)
(2分)
S=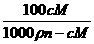 g (2分)
g (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com