
题目列表(包括答案和解析)
38.(8分)[物理一物理3-5]
静止的锂核(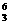 Li)俘获一个速度为
Li)俘获一个速度为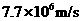 的中子,发生核反应后若只产生了两个新粒子,其中一个粒子为氦核(
的中子,发生核反应后若只产生了两个新粒子,其中一个粒子为氦核(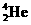 ),它的速度大小是
),它的速度大小是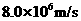 ,方向与反应前的中子速度方向相同.
,方向与反应前的中子速度方向相同.
(1)写出此核反应的方程式;
(2)求反应后产生的另一个粒子的速度大小及方向.
37.(8分)[物理-物理3-4]
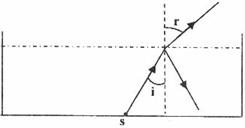 一足够人的水池内盛有某种透明液体,液体的深度为H,在水池的底部中央放一点光源,其中一条光线以30°入射角射到液体与空气的界面上,它的反射光线与折射光线的夹角为105°,如图.求:
一足够人的水池内盛有某种透明液体,液体的深度为H,在水池的底部中央放一点光源,其中一条光线以30°入射角射到液体与空气的界面上,它的反射光线与折射光线的夹角为105°,如图.求:
(1)这种液体的折射率;
(2)液体表面亮斑的面积.
36.(8分)[物理-物理3-3]
 (1)一种油的密度为
(1)一种油的密度为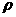 ,摩尔质量为M.取体积为V的油慢慢滴出,可滴n滴.将其中一滴滴在广阔水面形成面积为S的单分子油膜.求阿伏伽德罗常数.
,摩尔质量为M.取体积为V的油慢慢滴出,可滴n滴.将其中一滴滴在广阔水面形成面积为S的单分子油膜.求阿伏伽德罗常数.
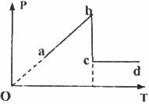
(2)一定质量的理想气体,按如图所示经历a-b、b-c、c-d
三种不同变化过程,
①其中表示等容变化的是哪个过程?
②由c到d过程中气体是吸热还是放热?说明你判断的理由.
35. (8分)[生物--现代生物科技专题]
2008年诺贝尔化学奖授予了三位在研究绿色荧光蛋白(GFP)方面做出突出贡献的科学家。绿色荧光蛋白能在蓝光或紫外光的激发下发出荧光,这样借助GFP发出的荧光就可以跟踪蛋白质在细胞内部的移动情况,帮助推断蛋白质的功能。下图为我同首例绿色荧光蛋白(GFP)转基因克隆猪的培育过程示意图,据图回答:
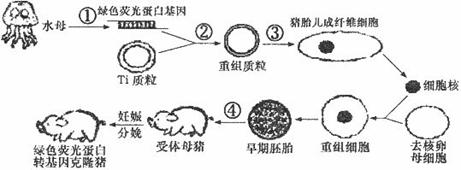
(1)绿色荧光蛋白基因在该实验中是作为________基因。图中过程③常用的方法是______;
在对转基因体细胞(猪胎儿成纤维细胞)的筛选时,比较简易的筛选方法是____________。
在进行过程④前,利用________技术可以获得数目更多且基因型相同的绿色荧光小鼠。
(2)如果将切取的GFP基因与抑制小猪抗原表达的基因一起构建到载体上,GFP基因
可以作为基因表达载体上的________,其作用是________________________________。
(3)目前科学家们通过蛋白质工程制造出了蓝色荧光蛋白、黄色荧光蛋白等,该工程是
直接改造____________。请写出该工程的基本流程:________________________ 。
34.(8分)[生物--生物技术实践]
与普通洗衣粉相比,加酶洗衣粉能更有效地清洗顽渍,同时减少对环境的污染,因此非
常受人们的欢迎。请分析回答下列有关问题:
(1)为探究洗衣粉加酶后的洗涤效果,在不同温度下分别进行如下实验:每次都将同种
无酶洗衣粉分成3等份,进行3组实验。甲、乙两组在洗衣粉中加入1种或2种酶,丙
组不加酶,在不同温度下清洗同种化纤布上的2种污渍,其他实验条件均相同,下表为
实验记录。
|
水温/℃ |
10 |
20 |
30 |
40 |
50 |
||||||||||
|
组别 |
甲 |
乙 |
丙 |
甲 |
乙 |
丙 |
甲 |
乙 |
丙 |
甲 |
乙 |
丙 |
甲 |
乙 |
丙 |
|
清楚血渍 时间/min |
67 |
66 |
88 |
52 |
51 |
83 |
36 |
34 |
77 |
11 |
12 |
68 |
9 |
11 |
67 |
|
清楚油渍 时间/min |
93 |
78 |
95 |
87 |
63 |
91 |
82 |
46 |
85 |
75 |
27 |
77 |
69 |
8 |
68 |
由上表可知,甲组在洗衣粉中加入的酶是_______,乙组在洗衣粉中加入了的酶是_______.
___________________。提高洗衣粉去污能力的方法有_________________________ 。
如果甲、乙和丙三组均在水温为80℃时洗涤同一种污渍,测试三组洗涤效果之间没有差异,说明理由______________________________。
(2)目前市场出售使用的加酶洗衣粉都是一次性的,某大型洗涤公司为了降低成本,他们使用一种技术将酶固定在不溶于水的某种载体上,洗涤完衣服后,经过简单处理,这些酶还可以多次重复利用;这种方法制成的酶叫_________________________。
(3)加酶洗衣粉中的淀粉酶可以从霉菌中提取,用固体培养基分离、纯化霉菌的方法是____________________;土壤中有很多微生物能分泌纤维素酶,在分离这些微生物的过程中应该以_______________作为唯一碳源。
(4)除加酶外,很多洗衣粉中还加有香精。高档洗衣粉中的香精都是由植物芳香油制成的,目前从植物中提取芳香油的方法有____________________等(写出两利,)。
33.(8分)[化学--有机化学基础]
与有机物B相关的反应信息如下:
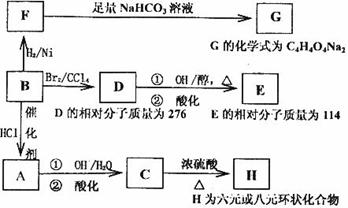
(1)写出下列反应的反应类型:
B→A______________,D→E第①步反应________________。
(2)写出E、C的结构简式:E_______________。C_______________。
(3)C的一种同分异构体K有如下特点:1molK可以和3mol金属钠发生反应放出33.6LH2(标准状况下),1molK可以和足量的NaHCO3溶液反应,生成1molCO2,1molK还可以发生银镜反应生成2moIAg,试写出K的结构简式________________________。
(4)写出在浓硫酸存在并加热的条件下,F与足量乙醇反应的化学方程式
________________________________________________________________。
32.(8分)[化学--物质结构与性质]
下表为长式周期表的一部分,其中的编号代表对应的元素。
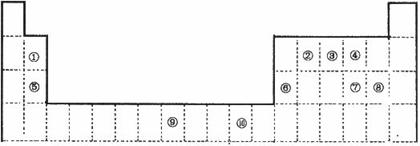
(1)表中属于d区的元素是___________(填编号);②和⑧形成的常见化合物的晶体
类型是______________。
(2)③、④两种元素的电负性大小为③_____________④(填“>”、“<”、“=”,下同),
它们的第一电离能大小为③_____________④。
(3)②、⑤、⑧元素的单质熔点高低的顺序是___________________(用编号表示)。
(4)③元素的氢化物在水中的溶解度比同族元素的其它氢化物大得多的原因是_________
_____________________________________
(5)1183K以下,⑨元素形成晶体的基本结构单元如图1所示,1183K以上基本结构单元转变为如图2所示,在两种晶体中最邻近的原予间距离相等。
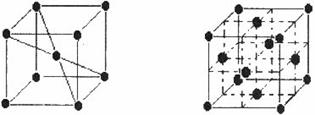
在图2中,与一个⑨原于等距离且最近的⑨原子的个数是_____________;图1与图2
中含有的⑨原子个数之比为__________________。
31.(8分)[化学--化学与技术]
工业上以磷肥生产形成的副产物石膏(CaSO4·2H2O)与焦炭为原料可生产硫酸,同时
可以得到硫酸钾肥料和氯化钙水合物储热材料。以下是有关的工艺流程示意图。
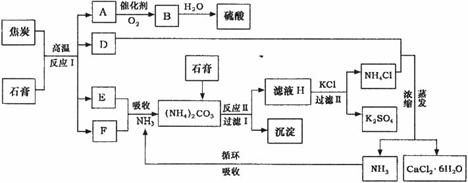
试回答:
(1)写出反应Ⅰ、反应Ⅱ的化学方程式
反应Ⅰ___________________________________,
反应Ⅱ______________________________________。
(2)请根据下表和化学平衡知识,分析工业上制硫酸中SO2的催化氧化的适宜条件是
____________________________________。
表Ⅰ:
 压 强 / M Pa
压 强 / M Pa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(3)检验滤液H中含有CO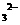 的方法是___________________________________。
的方法是___________________________________。
(4)氯化钙结晶水合物(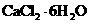 )是目前常用的无机储热材料,选择的依据是___________(填序号)。
)是目前常用的无机储热材料,选择的依据是___________(填序号)。
a.熔点较低(29℃熔化) b.能导电 c.易溶于水 d.无毒
30.(16分)为 探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如下图
所示的实验装置。
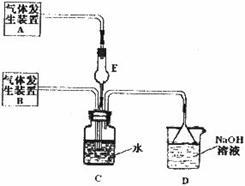
试填空。
(1)请你预测C12、SO2同时通入H2O中恰好发生反应后的产物(填写离子)_________。
设计简单的实验验证其中一种阴离子的存在____________________
(2)化学兴趣小组的同学为制取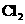 、
、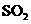 气体,现采用NA2SO3与70%的浓硫酸为原
气体,现采用NA2SO3与70%的浓硫酸为原
料制取SO2,采用MnO2和浓盐酸为原料制取C12。在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。
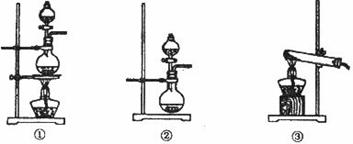
(3)上述整套装置有一处不合理,应在_________装置之间(填代号)连接一装置,请在答题纸的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)下列试剂中的一种就可以验证通入C装置中气体是Cl2过量还是SO2过量,该试剂是_________,实验现象及结论为_____________________________________________________
______________________________________。
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④碘化钾溶液
⑤品红溶液 ⑥酸性高锰酸钾溶液 ⑦液体四氯化碳
[选做部分]
共8个题,考生必须从中选择两个物理题、一个化学题和一个生物题在答题卡规定的区域作答。
29.(12分)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是_____________________。
,反应的氧化剂是_____________________。
(2)尾气中的SO2经处理可得到有价值的化学品,写出其中1种酸和1种盐的名称
____________________________。
(3)黄铜矿熔炼后得到的粗铜含少量Fe、Zn、Ag、Au等金属杂质,需进一步采用电解法精制。在精炼铜时,阳极材料是________,阴极电极反应式是_____________________。
(4)在精炼铜的过程中,电解液中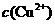 逐渐下降,
逐渐下降,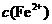 、
、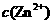 会逐渐增人,所以需定时除去其中的
会逐渐增人,所以需定时除去其中的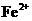 、
、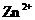 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
|
物质 |
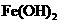 |
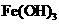 |
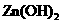 |
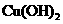 |
溶度积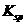 |
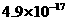 |
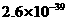 |
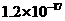 |
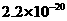 |
甲同学设计了如下除杂方案:
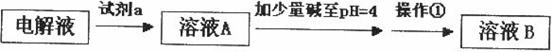
试剂a是__________,其目的是____________________________________;根据溶度积该方
案能够除去的杂质金属阳离子是____________。
乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7-8,可使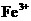 生成
生成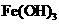 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7-8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是___________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com