
题目列表(包括答案和解析)
22.(18分)(1) ;
(2)__ _;(填>、<、=)
(3) mol·L-1; mol·L-1
(4)pH 7 (填>、<、=);
(5)按pH由大到小的顺序排列 (填序号)
21、(6分) , 。(填序号)
第Ⅱ卷(共60分)
24.(27分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有__________ _______(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_____ __(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先______ __,用少量蒸馏水洗涤后,再_______,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
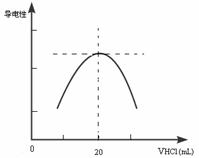 写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+ 浓度下降,这样,恰好完全反应时NH4+ 浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
2009-2010学年第一学期高二新课程模块专项练习答卷纸
第Ⅰ卷(共40分)
23. (9分)FeCl3溶液腐蚀印刷电路铜板的原理为:2Fe3++Cu=2Fe2++Cu2+,腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
|
除去CuCl2溶液中Fe3+和Fe2+的实验步骤 |
|
1、 |
|
2、 |
|
3、 |
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
22.(18分)如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1;
c (OH-)- c (HA)= mol·L-1
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列 (填序号)
21、(6分)溶质的物质的量浓度都为0.1mol/L的六种溶液:
①CH3COOH ②HCl ③NaOH ④CH3COONa ⑤KCl
这些溶液中含H+物质的量浓度由大到小的顺序是 ,pH由大到小的顺序是 。(填序号)
20.物质的量相同的下列溶液中,含粒子种类最多的是 ( )
A. CaCl2 B. CH3COONa C. NH3 D. K2S
第Ⅱ卷 (共60分)
19.将40℃的饱和澄清石灰水冷却至10℃或向其中加入少量CaO (但温度仍保持40℃),在这两种情况下均未改变的是 ( )
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Ca2+的数目
18.下列说法中,正确的是 ( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大
B.AgCl悬浊液中存在平衡: AgCl(s)≒Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
C.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl) > Ksp(AgI)
D.井水中含有较多Ca2+、Mg2+、HCO3―、SO42―,加热煮沸可以完全除去其中的Ca2+、Mg2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com