
题目列表(包括答案和解析)
16.(8分)(1)某温度下,纯水中c(H+)=5×10-7 mol·L-l,则此时纯水中的c(OH-) =___________;若保持温度不变,往甲、乙两瓶水中分别加入NaOH和Na2CO3,使溶液中的c(OH-)均为5.0×10-2 mol/L,则甲中水的电离程度 (填“增大、减小或不变”)、乙中水的电离 (填“增大、减小或不变”),用离子方程式表示乙溶液呈碱性的原因 。
(2)常温下,取物质的量浓度相同的NaOH和HCl溶液,以2:1的体积比相混合,所得溶液的pH 等于13,则原HCl溶液的物质的量浓度为
15. 物质的量浓度相同的下列物质,在指定的离子浓度的比较中正确的是( )
物质的量浓度相同的下列物质,在指定的离子浓度的比较中正确的是( )
A.C(H+):HCl>CH3COOH> -OH>H2CO3
B.C(CO32-):(NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3
C.C(NH4+):(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl
D.C(S2-):Na2S>H2S>NaHS>(NH4)2S
第Ⅱ卷(非选择题,共55分)
14.常温下,某强酸溶液pH=a,某强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系( )
A.V(碱)=V(酸) B.V(碱)=102 V(酸) C.102V(碱)=V(酸) D.无法确定
13.向100 mL2 mol·L-1的NaOH溶液通入CO2气体4.48 L(标准状况),对所得溶液的表述中正确的是( )
A. c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3)
B. c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-)
C. HCO3- 的电离程度大于HCO3-的水解程度
D. 存在的平衡有:NaHCO3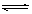 Na+ + HCO3-,
HCO3-
Na+ + HCO3-,
HCO3-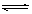 H+ + CO32- H2O
H+ + CO32- H2O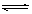 H++OH-
H++OH-
12.能证明氨水是弱电解质的事实是( )
① 氨水能使紫色石蕊试液变蓝. ② 氯化铵溶液显酸性 ③ 氨水能被弱酸醋酸中和
④ 常温下,0.1mol·L-1氨水中的c(OH-)为1.0×10-3mol·L-1
⑤ 物质的量浓度相同的氨水和氢氧化钠溶液,氨水的pH较小
⑥ 将pH=13的氨水稀释100倍,pH>11
A. ① ③ ④⑤ B. ②④⑤⑥ C. ③ ④⑤⑥ D. ① ④⑥
11.现有pH相同的电解质溶液:①Na2CO3溶液 ②NaHCO3溶液 ③CH3COONa溶液 ④ NaOH溶液,下列有关这四种溶液的说法中不正确的是( )
A.物质的量浓度最大的是①
B.稀释相同倍数时,其pH变化最大的是④
C.在上述四种电解质溶液中,分别加入AlCl3溶液,有气体产生的是①和②
D.②和④混合可发生复分解反应,生成①
10.当一个碳原子连有4个不同的原子或原子团时,这种碳原子被称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性。例如右图所示物质,其中带 * 号的碳原子即是手性碳原子,现使该物质发生下列反应:①与新制氢氧化铜反应,并酸化,得有机产物A ;
②与氢氧化钠水溶液共热得产物B和乙酸;则对所得产物A、B的描述正确的是( )
A.A、B均具有光学活性 B.A具有光学活性,B不具有光学活性
C.A不具有光学活性,B具有光学活性 D.A、B均不具有光学活性
9.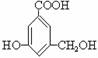 有机物A的结构简式如下, 下列有关A的性质叙述中,错误的是( )
有机物A的结构简式如下, 下列有关A的性质叙述中,错误的是( )
A.A与金属钠完全反应时,两者物质的量之比为1∶3
B.A与氢氧化钠完全反应时,两者物质的量之比为1∶1
C.A能与碳酸钠溶液反应
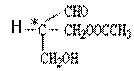 D.A既能与羧酸反应,又能与醇反应
D.A既能与羧酸反应,又能与醇反应
8. 某有机物的分子结构如右所示: CH3-C≡C-CH=CH- -C(CH3)3 ,该分子中最多可以有多少个碳原子共平面( )
某有机物的分子结构如右所示: CH3-C≡C-CH=CH- -C(CH3)3 ,该分子中最多可以有多少个碳原子共平面( )
A.9 B.11 C.13 D.15
7.下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)( )
A.乙酸乙酯 B.乙醛 C.乙醇 D.苯乙烯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com