
题目列表(包括答案和解析)
1.(6分)若设混合后的溶液体积为原混合液体积之和,计算下列混合液的PH。
(1)pH=3和pH=6的盐酸溶液等体积混合
(2)pH=12的NaOH溶液和pH=9的Ba(OH)2溶液等体积混合。
4.(8分)在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3 mol;
②O2的转化率为 ;
③平衡时容器内气体总物质的量为 mol;
④平衡时体系中SO3的百 分含量(体积分数)为 ;
⑤平衡时s(SO2)= mol/L;c(O2)= mol/L; c(SO3)= mol/L;
⑥若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
3.(4分)在100℃和200kPa的条件下,反应aA(g) 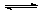 bB(g)+c
C(g)建立平衡后,在不
bB(g)+c
C(g)建立平衡后,在不
加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反
应建立平衡时物质B的浓度。
|
压强(kPa) |
200 |
500 |
1000 |
|
B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 转移(填“正向”或“逆向”或“不”),理由是 。
(2)压强从500kPa增加到1000kPa时,平衡 方向转移(填“正向”或“逆向”或“不”),其原因可能为 。
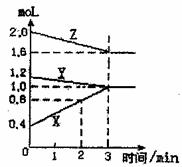 1.(6分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如右图所示,由图中数据分析:
1.(6分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如右图所示,由图中数据分析:
(1)该反应的化学方程式为
(2)反应开始至2分钟末,X的反应速率为:
(3)该反应是由 开始反应的(正、逆或
正逆同时)
2. (5分)25℃时,纯水中c(H+)·c(OH-)=1×10-14;100℃时,纯水中c(H+)·c(OH-)=1×10-12,说明温度升高,水的离子积常数变
,这是因为水的电离H2O H++OH-是
热反应。25℃时,在酸、碱的稀溶液中c(H+)·c(OH-)=
,这常数称为
,某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时
(5分)25℃时,纯水中c(H+)·c(OH-)=1×10-14;100℃时,纯水中c(H+)·c(OH-)=1×10-12,说明温度升高,水的离子积常数变
,这是因为水的电离H2O H++OH-是
热反应。25℃时,在酸、碱的稀溶液中c(H+)·c(OH-)=
,这常数称为
,某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时
c(OH-)= 。
22.将pH=5的盐酸溶液稀释1000倍后,溶液的pH为 ( )
A.等于8 B.等于7 C.略小于7 D.略大于7
第Ⅱ卷(非选择题,共34分)
21.在某温度下,可逆反应mA+nB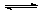 pC+qD平衡常数为K,下列说法正确的是( )
pC+qD平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变
D.K随着温度的升高而增大
20.在3NO2+H2O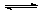 2HNO3+NO平衡体系中通入O2,则化学平衡 ( )
2HNO3+NO平衡体系中通入O2,则化学平衡 ( )
A.不移动 B.向生成HNO3的方向移动
C.最终向生成NO2的方向移动 D.移动方向视通入O2的量而定
19.如右图曲线,在其他条件一定时,反应2NO+O2=2NO2+Q(Q>0)中NO的最大转化率
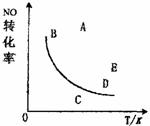 与温度的关系曲线,图上的A、B、C、D、E五点其中表示未达平衡状态且V正>V逆的是
与温度的关系曲线,图上的A、B、C、D、E五点其中表示未达平衡状态且V正>V逆的是
A.A或E
B.C
C.B
D.D
18.将体积都为10mL,pH都等于12的氨水和氢氧化钠,分别加水稀释到a mL和b Ml,测得稀释后两溶液的pH值都等于10,则a与b的关系是 ( )
A.a=b=100mL B.a=b=1000mL C.a<b D.a>b
17.已知可逆反应A+2B 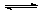 2M+N(正反应为放热反应),在一定条件下达到平衡时,A在反应混合物中的质量分数为a%,若要通过改变条件使A的质量分数变为2a%,则下列各项可改变的条件中,一定能达到目的的是(其中a<50) ( )
2M+N(正反应为放热反应),在一定条件下达到平衡时,A在反应混合物中的质量分数为a%,若要通过改变条件使A的质量分数变为2a%,则下列各项可改变的条件中,一定能达到目的的是(其中a<50) ( )
A.增大容器体积 B.增大反应容器内压强
C.升高反应温度 D.使用适量催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com