
题目列表(包括答案和解析)
5.已知某反应的各物质浓度数据如下: 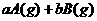

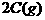
起始浓度(mol·L-1) 

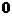
2s末浓度(mol·L-1) 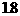
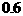
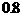
据此可推算出上述方程式中各物质的计量数之比是 ( )
A. 9:3:4 B. 3:1:2 C. 2:1:3 D. 3:2:1
4.可逆反应A(g)+3B(g)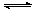 2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是 ( )
2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是 ( )
A.v (A)=0.15mol/(L·min) B.v (B)=0.6 mol/(L·min)
C.v (C)=0.3 mol/(L·min) D.v (D)=0.1 mol/(L·min)
3.甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率与乙容器内的反应速率相比 ( )
A.甲快 B.甲慢 C.相等 D.无法判断快慢
2.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为 ( )
A.v(NH3)=0.010mol/(L·s) B.v(O2)=0.0010mol/(L·s)
C.v(NO)=0.0010mol/(L·s) D.v(H2O)=0.045mol/(L·s)
1.不同的化学反应有不同的反应速率,决定化学反应速率的主要因素是 ( )
A.温度 B.浓度 C.催化剂 D.反应物的性质
14.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)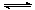 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
[专题2] 1-2化学反应速率与反应限度
13.下表表示合成氨反应(N2+3H2  2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
 压强(MPa)
压强(MPa) 氨的含量 氨的含量温度(℃) |
0.1 |
10 |
30 |
60 |
100 |
|
200 |
0.153 |
0.815 |
0.899 |
0.954 |
0.988 |
|
300 |
0.022 |
0.520 |
0.710 |
0.842 |
0.926 |
|
400 |
0.004 |
0.251 |
0.470 |
0.652 |
0.798 |
分析上表数据,回答下列问题:
(1)欲使平衡混合物中氨的含量增大,则可采取的措施有
(2)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强,
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是
(3)欲使平衡混合物中氨的含量为0.710,则可选择的反应条件为
12.在20℃时,将a molH2(g)和b mol I2 (g) 充入到体积为VL的密闭容器中,发生反应:
H2(g)+I2(g)  2HI(g)
2HI(g)
(1)反应刚开始时,c(H2)= mol/L , c (I2)= mol/L ,c (HI)= mol/L, 所以化学反应速率 反应速率最大(用“正” “逆”填空,下同),而 反应速率最小(为零)(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为 c(H2) , c(I2) 而c(HI) 从而使化学反应速率V正 而V逆 (填“逐渐增大”或“逐渐减少”)
(3)当反应进行到V正与V逆 时,此反应就达到了平衡状态,若外界条件不变时,反应混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率等都将
11.点燃氢气和氧气的混合物可剧烈地化合生成水,电解水时又可生成氢气和氧气,这是不是一个可逆反应?为什么?
10.在一定温度下, 硫酸铜晶体在饱和水溶液中有如下平衡: CuSO4+ X H2O CuSO4.X H2O 当溶液中加入少量无水硫酸铜时,下列说法正确的是 ( )
CuSO4.X H2O 当溶液中加入少量无水硫酸铜时,下列说法正确的是 ( )
A.溶液中铜离子浓度增大 B.溶液中铜离子浓度减小
C.硫酸铜晶体变大 D.溶液颜色变浅
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com