
题目列表(包括答案和解析)
20. (6分) 将一定量的SO2和含89.6 L空气(除N2和 O2外忽略其他成分的存在,二者体积之比为4:1)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了26.88 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了6.72L(以上气体体积均折算为标准状况下的体积)。
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了26.88 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了6.72L(以上气体体积均折算为标准状况下的体积)。
请回答下列问题:
(1)判断该反应达到平衡状态的标志是_______。(填字母)
a.O2和SO3浓度之比为1:2 b.SO2百分含量保持不变
c.容器中气体的总质量不变 d.SO3的消耗速率与SO2的消耗速率相等
e.容器中的化学反应停止
(2)欲提高SO2的转化率,下列措施可行的是_______。(填字母)
a.保持温度不变,缩小容器的体积 b.向装置中再充入SO2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率_______(用百分数表示,计算结果保留一位小数)。
19.(14分)(1)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
 ①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____ _。直到因加入一滴盐酸后,溶液由红色变为无色,并且__
_ 为止;
①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____ _。直到因加入一滴盐酸后,溶液由红色变为无色,并且__
_ 为止;
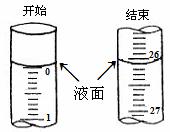
②若滴定开始和结束时,酸式滴定管中的液面如图所示:则所滴定盐酸的体积为_________mL;
(2)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测。
①该学生的操作是 (正确或错误)。
②如不正确,请分析是否一定有误差,为什么? 。
③若用此法分别测定c(H+)相同的盐酸和醋酸的稀溶液的pH,误差较大的是 ___________,原因是 。
18.(10分)某温度(t℃)时,水的KW=10-13,则该温度应______25℃(填大于、等于或小于),理由是_______________________________________________,该温度下纯水的pH值为 ,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=_________;
(2)若所得混合溶液pH=2,则a:b=__________。
17.(8分)下列物质中,①HClO4;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦CO2;⑧O2;⑨H2O,________________是强电解质;______________是弱电解质;离子方程式中必须写成离子形式的是 (以上直接填写编号);写出④的电离方程式 。
16.(10分)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
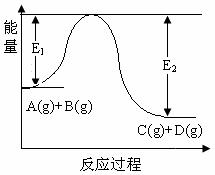
(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”“不变”),原因是______________________________________________。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_______,E2_______(填“增大”“减小”“不变”)。
15.(8分)
自由能△G=△H-T△S判断化学反应的自发性更科学,等式中T为热力学温度,恒大于零。当:△G<0,过程自发;△G>0,过程不自发(逆过程自发);△G=0,达到平衡态。已知:C(石墨,S)=C(金刚石,S),△H=+1.9 kJ·mol-1,△S=-3.4 J·mol-1·K-1。回答下列问题:
(1)石墨比金刚石 (稳定或不稳定),常温下石墨转化为金刚石是 (自发或非自发)过程。
(2)地下核爆炸会使地层中的碳生成少量金刚石,判断核爆炸产生的高温能否改变该反应的自发性? 。根据该事实分析,你认为某些特殊反应的自发性有时还与 有关。
14.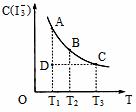 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) , 某 I2、KI混合溶液中,
I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) , 某 I2、KI混合溶液中,
I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )
A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
Ⅱ 非选择题
13. 在一个固定容积的密闭容器中,加入2molA和1molB,发生
2A(g)+B (g) 3C(g) +D(g),达到化学平衡时,C的浓度为wmol/L。若保持温度容积不变,改变起始物质的用量,达到平衡后,C的浓度仍为wmol/L的是:( )
3C(g) +D(g),达到化学平衡时,C的浓度为wmol/L。若保持温度容积不变,改变起始物质的用量,达到平衡后,C的浓度仍为wmol/L的是:( )
A.4molA+2molB B.1molA+0.5molB+1.5molC+0.5molD
C.3molC+1molD+1molB D.3molC+1molD
12. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH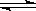 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是(
)
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是(
)
A 加少量烧碱固体 B 升高温度 C 加少量冰醋酸 D 加CH3COONa
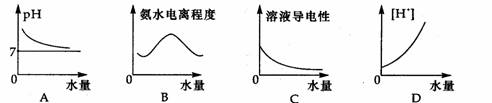
11. 25℃时,将水不断滴入0.1mol/L的氨水中,下列变化的图象合理的( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com