
题目列表(包括答案和解析)
4.在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )。
A. v(H2)=0.3mol·L-1·min-1 B. v(N2)=0.05mol·L-1·s-1
C. v(N2)=0.2mol·L-1·min-1 D. v(NH3)=0.3mol·L-1·min-1
2.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) DH=+890KJ·mol-1
B.CH4 (g) + 2O2(g)
== CO2(g) +2H2O(l) DH= +890KJ·mol-1
(g) + 2O2(g)
== CO2(g) +2H2O(l) DH= +890KJ·mol-1
C.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) DH=-890KJ·mol-1
D.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) DH= -890KJ·mol-1
|
A.A池为电解池,B池为原电池
B.D、E两极都发生氧化反应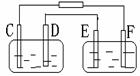
C.E极应为粗铜板材料
|
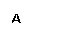 D.B池中E极质量增加12.8g
D.B池中E极质量增加12.8g1.2009年是勒夏特列(1850-1936)诞辰159周年,他发现的平衡移动原理在工、农业生产和日常生活中有许多重要应用。下列事实中,能用勒夏特列原理解释的是 ( )
A. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
B. 由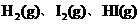 组成的平衡体系,加压后颜色加深
组成的平衡体系,加压后颜色加深
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. 500℃左右比室温更有利于合成氨的反应
33.(5分) 某温度下,在装有催化剂的容积为2 L的密闭容器中,充入SO2和O2各4 mol ,发生反应:2SO2(g) +O2(g) 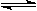 2SO3(g)。充分反应5 min后达到平衡,测得反应容器内混合气体的压强为原来的80 %。求:(本题要求写出计算过程)K^S*5U.C#O%
2SO3(g)。充分反应5 min后达到平衡,测得反应容器内混合气体的压强为原来的80 %。求:(本题要求写出计算过程)K^S*5U.C#O%
(1)SO2的转化率
(2)该反应的平衡常数。
32.(10分)近来,制备和利用氢气这一清洁能源已有多项成果。
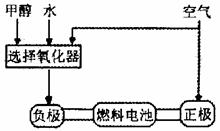 (1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如右图所示,请观察此图回答:
(1)德国克莱斯公司成功研制了利用甲醇(CH3OH)车载制氢燃料电池工艺,其原理如右图所示,请观察此图回答:
①燃料电池的正极反应式为 ;
②甲醇与流程图中任一反应物反应制取氢气 的化学方程式

(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
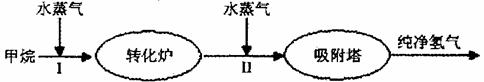
①此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;
②此流程的第II步反应的平衡常数随温度的变化如表一,在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
表一
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
表二
|
实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
3 |
3 |
0 |
0 |
|
D |
0.5 |
2 |
1 |
1 |
 ③若400℃时,第Ⅱ步反应生成l mol氢气的热效应值为33.2(单位为kJ),第Ⅰ步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为
③若400℃时,第Ⅱ步反应生成l mol氢气的热效应值为33.2(单位为kJ),第Ⅰ步反应的热化学方程式为:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ·mol-1。则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为

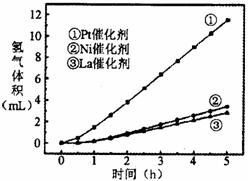
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,右图是三种催化剂在光照分解水实验中的效果比较图。能得出如图结果的实验方案是
。
31.(6分)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。K^S*5U.C#O%
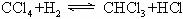
此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃
(1)在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
|
实验 序号 |
温度℃ |
初始CCl4浓度 (mol·L-1) |
初始H2浓度(mol·L-1) |
CCl4的平衡转化率 |
|
1 |
110 |
0.8 |
1.2 |
A |
|
2 |
110 |
1 |
1 |
50% |
|
3 |
100 |
1 |
1 |
B |
①此反应在110℃时平衡常数为 。
②实验l中,CCl4的转化率A 50%(填“大于”、“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为 。在此实验的平
衡体系中,再加入0.5 mol CCl4和1.0 mol HCl,平衡将向 方向移动。
④实验3中,B的值
(选填序号)
A.等于50% B.大于50% C.小于50% D.从本题资料,无法判断
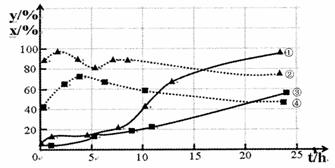 (2)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L一1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如下图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。在图中的四条线中,表示H2起始浓度为2mol·L一1实验的消耗CCl4的百分率变化曲线是
(选填序号)。
(2)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L一1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如下图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。在图中的四条线中,表示H2起始浓度为2mol·L一1实验的消耗CCl4的百分率变化曲线是
(选填序号)。
30.(8分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
|
序号 |
内 容 |
实验现象 |
|
1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
|
2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
|
3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
|
4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
|
5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
|
6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
|
7 |
将铁丝放在燃煤的厨房中一个月 |
铁丝表面已变得灰暗K^S*5U.C#O% |
回答以下问题:K^S*5U.C#O%
(1)上述实验中发生了吸氧腐蚀的是 (填实验序号),负极反应是______ ____;发生的腐蚀是析氢腐蚀的是 (填实验序号),正极反应是 。
(2)由该实验可知,可以影响铁锈蚀速率的因素有_____ _____________________;
(3)为防止铁的锈蚀,地下埋的水管采用外接电源阴极保护法,则接电源的负极应是 ;请列举工业上普遍采用的其它方法是 、 (答两种方法)。K^S*5U.C#O%
29.(5分) 已知反应:aA(g)+bB(g) 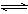 cC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
cC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应为 (填“吸热反应”或“放热反应”),且a+b c(填“>”、“=”或“<”)。
(2)若降低温度,则平衡时B、C的浓度之比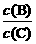 将
(填“增大”、“减小”或“不变”) 。
将
(填“增大”、“减小”或“不变”) 。
(3)若B是有色物质,A、C均无色,维持容器体积不变,加入C时,混合物颜色 ;维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”、“变浅”或“不变”)。
28.(6分)恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
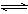 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol, a = 。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。平衡时NH3的物质的量为 。K^S*5U.C#O%
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= 。K^S*5U.C#O%
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)= 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=
27.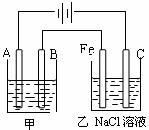 (6分)如图为相互串联的甲乙两个电解池,甲池若为用电解精炼铜的装置,请回答:
(6分)如图为相互串联的甲乙两个电解池,甲池若为用电解精炼铜的装置,请回答:
(1)A极材料和B极材料分别是 ( )
a. 石墨、精铜 b. 石墨、粗铜
c.粗铜、精铜 d.精铜、粗铜
(2)甲槽中电解质溶液为_________。
(3)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_________L。K^S*5U.C#O%
(4)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为__________ mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com