
题目列表(包括答案和解析)
1.在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式……主要污染物排放得到有效控制。”下列做法符合该指导思想的是
A.大量使用合成洗涤剂洗涤衣物
B.大量使用尿素替代碳酸氢铵以提高农作物产量
C.大量使用一次性竹、木筷子以推动林业发展
D.大量利用垃圾生产燃料、肥料“变废为宝”
25. (8分) 已知有机物A的相对分子质量不超过200。取1.48 g A完全燃烧后,将燃烧产物通过碱石灰,碱石灰的质量增加2.12g;若将燃烧产物通过浓硫酸,浓硫酸的质量增加0.36 g;取1.48 g A与足量钠反应,生成的气体在标准状况下的体积为0.336L。
(1) 1.48 g A完全燃烧生成的CO2的物质的量为________mol。
(2) A的分子式为_______________。
(3) A能使紫色石蕊试液变红,且A经催化氧化后分子中只有一种氢原子,则A的结构简式为_____________。
(4) 将a g A完全燃烧后的产物全部通入足量的Na2O2固体充分吸收,则固体质量增加
____________g。
(命题人:曹 健 审题人:蒋邦龙)
西南师大附中2009-2010学年度下期期末考试
24. (14分) 某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。
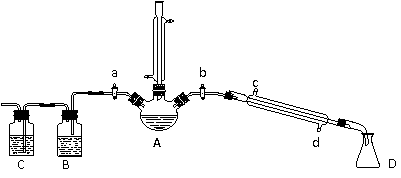 请根据实验步骤,回答下列问题:
请根据实验步骤,回答下列问题:
(1) 关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是_____________________。
(2) ①理论上,上述反应的副产物可能有:丁醚、________________(填结构简式)、溴化氢、硫酸氢钠、水等。
②熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是__________;___________
③有同学通过某仪器鉴定所得产物中含有“-CH2CH2CH2CH3”, 从而确定副产物中存在丁醚。该同学的观点___________(填“正确”或“错误”)原因是____________
_______________________________________。
(3) 为了进一步分离、提纯1-溴丁烷,该兴趣小组同学查得相关有机物的有关数据如下:
请你补充下列实验步骤,直到分离出1-溴丁烷。
|
物质 |
熔点/℃ |
沸点/℃ |
|
1–丁醇 |
–
89.5 |
117.3 |
|
1–溴丁烷 |
–
112.4 |
101.6 |
|
丁醚 |
–
95.3 |
142.4 |
|
1–丁烯 |
–
185.3 |
–
6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③______________________;
④接通冷凝管的冷凝水,使冷水从________处流入;
⑤迅速升高温度至____________℃收集所得馏分。
(4) 若实验中所取1–丁醇、NaBr分别为7.4 g、13.0 g(浓H2SO4足量),蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1–溴丁烷,则1–溴丁烷的产率是____________。
23. (5分)《硫酸铜晶体里结晶水含量的测定》是中学化学中的一个重要实验,请回答下列该实验的相关问题。
(1) 实验中能直接加热的仪器名称为____________;进行的称量操作至少为________次。
(2) 下列操作会引起测定结果偏高的是__________________
A.加热时温度过高CuSO4发生分解 B.加热后在空气中冷却再称量
C.加热过程中有晶体溅出 D.晶体部分风化
22. (15分) 芳香族化合物甲、乙、丙、丁互为同分异构体,其分子式为C9H8O2,有关的转化关系如下图所示。已知:甲、乙、丁分子中无甲基,0.1 mol D与足量的NaHCO3反应,生成标准状况下的气体4.48 L。
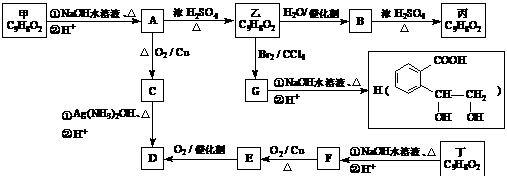
提示:①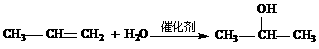
②
(1) 甲的结构简式为 。
(2) A→乙的反应类型属于 反应,下列有机物中与C 互为同系物的是 。
a.OHC-(CH2)4-COOH b.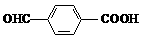
c.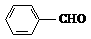 d.
d.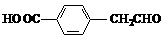
(3) 写出下列反应的方程式(有机物用结构简式表示)
B→丙 ;
丁→F反应 ① 。
(4) X是E的同分异构体,X遇FeCl3溶液显色,能与NaHCO3反应, 1 mol X与足量的Na反应生成1 mol H2,X分子中苯环上只有两个取代基(不含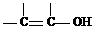 结构),则X的结构简式为
(任写一种)。
结构),则X的结构简式为
(任写一种)。
(5) 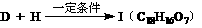 ,满足该条件的I共有
种
,满足该条件的I共有
种
21. (12分) 某有机物A是葡萄糖在人体内的一种代谢产物,与甲醛具有相同的实验式,相对分子质量为90,A具有酸性,能分别与浓硫酸在一定条件下生成有机物B或C,B是一种六元环状化合物,C能够使溴水褪色且在一定条件下可以生成高聚物D。
请回答下列问题:
(1) 葡萄糖的结构简式为__________________。
(2) A的分子式为______________。
(3) A的结构简式为______________。
(4) 写出下列反应方程式:
①A→C_________________________________________________________________;
②C→D_________________________________________________________________。
20. (11分) 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1) 第VIA族元素形成的气态氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2) 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
 33.35 33.35 |
 164 164 |
(3) 第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4) 碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。

19. (13分) A、B、C、D四种芳香族化合物,它们的结构简式如下所示:
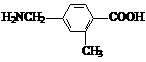
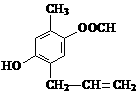
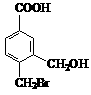
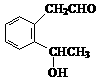
A B C D
请回答下列问题:
(1) D中含氧官能团的名称是________________________。
(2) 能与新制Cu(OH)2反应产生红色沉淀的是________________(填序号)。
(3) A不能发生的反应是________________(填序号)。
①取代反应 ②加成反应 ③消去反应 ④加聚反应 ⑤与盐酸反应
(4) 等物质的量的B、C与足量的NaOH溶液反应,消耗的NaOH物质的量之比为________。
(5) A在一定条件下可以生成一种高分子化合物E,E的结构简式为_________________。
(6) 请写出D与CuO反应的化学方程式:_______________________________________。
18. A、B、C、D、E、F六种元素在周期表中的位置如图所示,下列说法正确的是( )
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
|
|
|
D |
|
|
3 |
B |
|
|
|
E |
C |
F |
|
A.热稳定性:A2C>AD
B.EF3分子中所有原子均达到8电子稳定结构,且属于非极性分子
C.六种元素中的某些元素可以形成既含共价键又含离子键的化合物
D.晶体熔点:BF<BD
第Ⅱ卷 非选择题(共78分)
17. NA为阿伏加德罗常数,下列说法正确的是( )
A.SiC与金刚石结构相似,则1mol SiC中含有的共价键数目为4NA
B.1 mol苯中含有3NA个碳碳双键
C.1 mol羟基中含有的电子数为7NA
D.13 g苯,乙炔和聚苯乙烯的混合物中含有的碳原子数为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com