
题目列表(包括答案和解析)
19.(8分)砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。砷化镓的晶胞结构如右图。试回答:
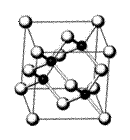 (1)As的核外电子排布式为 。
(1)As的核外电子排布式为 。
(2)砷化镓晶胞中所包含的Ga原子个数为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As>Ga
C.电负性:As>Ga D.砷化镓晶体中含有配位键
(4)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法在700℃时制备得到。AsH3的空间形状为 ,(CH3)3Ga中镓原子的杂化方式为 。
(5)AsH3沸点比NH3低,其主要原因是 。
18.(6分)向盛有KI溶液的试管中加入少许 后滴加氯水,
后滴加氯水, 层变成紫色。如果继续向试管中滴加氯水,振荡,
层变成紫色。如果继续向试管中滴加氯水,振荡, 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
2)把KL换成KBr,则 层变为红棕色:继续滴加氯水,
层变为红棕色:继续滴加氯水, 层的颜色没有变化。
层的颜色没有变化。 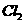 、
、 、
、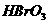 氧化性由强到弱的顺序是
。
氧化性由强到弱的顺序是
。
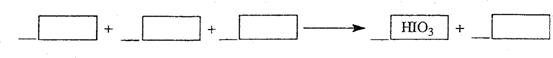
3)加碘盐中含碘量为20mg-50mg/kg。制取加碘盐(含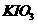 的食盐)1000kg,若庄Kl与
的食盐)1000kg,若庄Kl与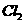 反应制
反应制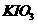 ,至少需要消耗
,至少需要消耗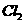 ________L(标准状况,保留2位小数)
________L(标准状况,保留2位小数)
17.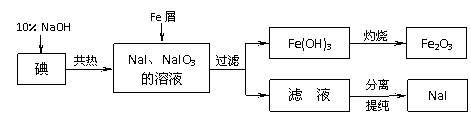 (8分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(8分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(1)判断碘是否已完全反应的实验方法是 ;
(2)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,最好采取的措施是
;
(3)测定产品中NaI含量的方法是:a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.1000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
① 上述测定过程所需仪器中,需要检查是否漏液的仪器有 。
② 上述样品中NaI的质量分数为 。
16.下列离子方程式正确的是 ( )
A.向银氨溶液中滴加盐酸:[Ag(NH3)2]+ + OHˉ + 3H+ = Ag+ + 2NH4+ + H2O
B.Fe(OH)3溶于氢碘酸:2Fe(OH)3 + 6H+ + 2Iˉ = 2Fe2+ + I2 + 6H2O
C.向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42ˉ离子沉淀完全
Al3+ + 2SO42ˉ + 2Ba2+ + 4OHˉ = AlO2ˉ + 2BaSO4↓+ 2H2O
D.向Na2S2O3溶液中通入足量氯气:S2O32ˉ+2Cl2+3H2O=2SO32ˉ+4Clˉ+6H+
第II卷 非选择题(72分)
15.甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙和甲中同种元素的质量分数相等,则乙中一定含有-l价的元素
C.丙与氧气的摩尔质量相同,则丙一定含有极性键和非极性键
D.丁中含有第2周期ⅣA族的元素,则丁一定是甲烷的同系物
14.在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.AlCl3溶液:K+、Na+、SO42-、AlO2-
D.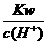 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
13.在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A.1/5 mol B.2/5 mol
C.3/5mol D.11/5 mol
12.元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能。下表中给出了几种元素或离子的电子亲合能数据;:
|
元素 |
Li |
Na |
K |
O |
O- |
F |
|
电子亲合能/kJ·mol-1 |
59.8 |
52.7 |
48.4 |
141 |
-780 |
327.9 |
下列说法正确的是 ( )
A.电子亲合能越大,说明越难得到电子
B.一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量
C.氧元素的第二电子亲合能是-780kJ·mol-1
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
11.已知H2O2的分子空间结构可在二面角中表示,如图所示。在有关H2O2结构的说法中正确的是
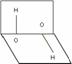 A. 分子的正、负电荷中心重合
A. 分子的正、负电荷中心重合
B. 分子的正、负电荷中心不重合
C. H2O2是极性分子
D. H2O2是非极性分子
10.下列物质的变化规律,与共价键的键能有关的是
A.F2、Cl2、Br2、I2的熔、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com