
题目列表(包括答案和解析)
9.在密闭容器中,一定量混合气体发生下列反应: aM(g)+
bN(g) cW(g),达平衡后,测得M气体的浓度为0.5mol/L。恒温条件下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
cW(g),达平衡后,测得M气体的浓度为0.5mol/L。恒温条件下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
A.反应速率增大 B.平衡向右移动
C.N的转化率提高 D.W的体积分数降低
8.强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
A.1 : 1 B.2 : 1 C.1 : 10 D.10 : 1
7.四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:① v(A)= 0.15mol/(L·s) ②v(B)= 0.6mol/(L·s) ③v(C)= 0.4mol/(L·s) ④v(D)= 0.45mol/(L·s)。其中,反应最快的是
A.① B.② C.③ D.④
6.用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是
A.HCl B.NaOH C.Na2SO4 D.NaCl
5. 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是
A.⊿H1>⊿H2>⊿H3 B.⊿H1<⊿H3<⊿H2
C.⊿H1<⊿H2<⊿H3 D.⊿H1>⊿H3>⊿H2
4.下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+ H2O  HBr+ HBrO 加入AgNO3溶液后,溶液颜色变浅
HBr+ HBrO 加入AgNO3溶液后,溶液颜色变浅
B.对CO(g) + NO2 (g)  CO2 (g)+
NO(g) 平衡体系增大压强可使颜色变深
CO2 (g)+
NO(g) 平衡体系增大压强可使颜色变深
C.工业合成 NH3,为提高 NH3的产率,理论上应利用高压条件
D.工业合成 NH3,为提高 NH3的产率,理论上应采取相对较低温度的措施
3.下列说法不正确的是
A.焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B.自发进行的反应一定能迅速进行
C.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
D.一个反应能否自发进行,由焓变和熵变共同决定
2.把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H2产生量的操作是
A.加入适量CH3COONa溶液 B.加入适量KNO3溶液
C.加入适量的K2CO3溶液 D.加入适量Na2SO4固体
1.下列对化学反应的认识错误的是
A.必然会引起化学键的变化 B.必然会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
26(20分)、按要求完成下列填空:
(1)、把下列晶体:①水晶②干冰 ③氯化钠 ④氯化铯 ⑤钠的熔点按由高到低的顺序排列: 。
(2)R、X、Y、Z为四种常见的短周期元素,它们的原子序数依次增大。这四种元素可形成RX2、Y2X、Y2X2、YZ、RZ4等化合物,R元素的气态氢化物RH4中,R的质量分数为75 %。A是一种只含碳、氢、氧三种元素的有机物,分子量为166;其分子中含有苯环,且苯环上有两个处于对位的相同取代基;A能溶于NaHCO3溶液,并产生气体RX2。 ① 推断R、X、Y、Z分别是什么元素,写出R、Y的元素符号:R Y
②固态Y2X、RZ4分别属于哪类晶体? 晶体 晶体
③ 在化合物RX2、Y2X、Y2X2、YZ、RZ4中,具有共价键的离子晶体的化学式为 ,其电子式为 ;RX2的结构式为 RZ4的电子式为 _。
④A的分子式为 ;液态A能与单质Y发生反应,反应的方程式为:
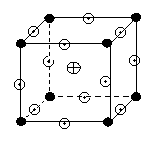
(3)、右图为一高温超导化合物--钙钛氧晶体结构模型,该模
型是晶体的最小可重复单元。其中钙位于模型的中心,立方体
的顶点为钛,每一条棱的中心有一个氧,请回答:
①与每个钛离子最接近且等距离的钛离子、钙离子、氧原子分别
有 、 、 个;钛、钙、氧的微粒个数比为
(4)某晶体只由一种元素组成,其密度为3.0g·cm-3,用X射线研究该晶体的结构时知,在边长为1×10-7cm的正方体中含有18个原子。则该元素的相对原子质量为 。
27(7分)、测定硫酸铜晶体(CuSO4· nH2O)里结晶水的数目n,实验步骤为:

 w_w w. k#s5_
w_w w. k#s5_
①在实验用品甲中将硫酸铜晶体研碎; ②称得干燥的容器乙的质量为m g;
③称得容器乙与晶体试样的总质量为x g;
④加热容器乙至晶体完全变成白色粉末,不再有水蒸气逸出时,立即放入干燥器内冷却至常温,再称得容器乙与固体的总质量;
⑤重复步骤④的操作,直到连续两次称量的质量差不超过0.1g,记录所称得的容器乙与无水CuSO4的总质量为y g ;
⑥根据实验数据计算硫酸铜晶体水的数目。
请回答下列问题:
⑴实验用品甲的名称是 ,乙的名称是 。
⑵该实验中使用干燥器的目的是 。
⑶测定结果,n= (用含m、x、y的代数式表示)
⑷若操作正确而实验测得的硫酸铜晶体中结晶水的数目偏大,其原因可能有
A、被测样品中含有少量NH4Cl固体 B、被测样品中含有少量SiO2
C、加热时间过长或温度过高,出现黑色固体 D、加热前所用的容器甲未完全干燥
E、在干燥器中冷却样品时,没有盖上干燥器的盖子
28(16分)、溴水中溴单质能与水反应,存在下列平衡体系:Br2+H2O HBr+ H Br O ,H Br O的结构式为H-O-Br 。乙烯通入溴水常有副反应发生,如下图所示,乙烯跟溴水反应可生成A、B、C三种物质并能发生一系列转化:
HBr+ H Br O ,H Br O的结构式为H-O-Br 。乙烯通入溴水常有副反应发生,如下图所示,乙烯跟溴水反应可生成A、B、C三种物质并能发生一系列转化:

 w_w w. k#s5_
w_w w. k#s5_
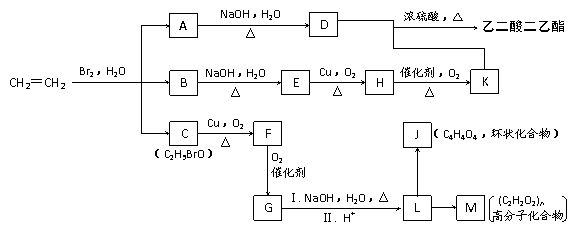
回答下列问题:
(1)推断下列物质的结构简式:
A ,B ,C ,J
写出C中所含有的官能团名称为:
(2)写出下列反应的化学方程式:
 ① B E
① B E
②D + K -→ 乙二酸二乙酯 ,
 ③F G
③F G
④L -→ M
(3)化合物A-M中,能与H2发生加成反应的物质是(填字母) 。
30(7分)、某有机物,对其的组成、结构、性质进行观察、分析,得实验结果如下: ①、该物质能溶于水,在其水溶液中加入银氨溶液水浴加热,未见银镜生成; ②、在其水溶液中加入稀硫酸,经加热,所得产物可与新制备的Cu(OH)2悬浊液反应,并生成红色沉淀;
③、该物质相对分子质量为342。在纯氧中完全燃烧34.2g该有机物,只得到52.8gCO2和19.8gH2O; 请回答:(1)该有机物的的分子式和名称分别为:
写出判断该有机物是否含有氧元素的计算过程:

 w_w w. k#s5_
w_w w. k#s5_
(2)写出上述第②步实验中所描述的反应的化学方程式为:


 w_w w. k#s5_
w_w w. k#s5_
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com