
题目列表(包括答案和解析)
23.某课外活动小组同学用下右图装置进行实验,试回答下列问题。
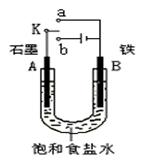 ⑴若开始时开关K与a连接,则B极的电极反应式为
⑴若开始时开关K与a连接,则B极的电极反应式为
。
⑵若开始时开关K与b连接,总反应的离子方程式
为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电
解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中
转移0.2 mol电子
⑶该小组同学模拟工业上用离子交换膜法制烧碱
的方法,那么可以设想用右图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”
或“小于”或“等于”)通过阳离子交换膜的离子数。
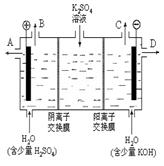 ②制得的氢氧化钾溶液从出口(填写“A”、“B”、
②制得的氢氧化钾溶液从出口(填写“A”、“B”、
“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述
原因 。
22.已知:向一体积为2L的密闭容器中加入0.1mol碘单质和足量的钨,当温度为943K时 存在:W(s)+I2(g)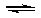 WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
 (1)求943K时此反应的平衡常 数:K=_____________
(1)求943K时此反应的平衡常 数:K=_____________
(2)若起始时向此密闭容器中再加入0.1mol WI2 达平衡,此时容器中各气体的体积 比:___________,当同时加入等物质的量I2(g) 和WI2(g),平衡___________方向移动(填正反 应、逆反应或不移动)
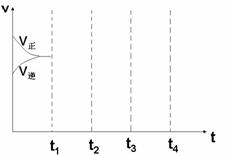
⑶画出W(s) + I2(g)  WI2(g) △H<0时 间-速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
WI2(g) △H<0时 间-速率图。一定温度过量W 反应达 平衡, 到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
(4)一定温度下,向一容积不变的容器中加入足量钨和1molI2(g),使之反应: W(s) + I2(g)  WI2(g) ΔH= -40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
WI2(g) ΔH= -40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
21.常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
⑴用化学用语表示该溶液中的三个平衡关系是:
①______________________________________;
②______________________________________;
③______________________________________。
⑵这些微粒中浓度为0.01mol/L的是________,浓度为0.002mol/L的是_________。
⑶物质的量之和为0.01mol的两种微粒是_________________。
⑷ _________和________两种微粒数量之和比OH-多0.008mol。
20.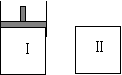 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加 入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):aX(?) +2Y(?)
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加 入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):aX(?) +2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为 3:2:2,则下列说法一定正确的是( )
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分 数变大
Ⅱ 卷
19.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO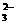 和OH-
和OH-
B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大 到小的顺序是:c(Na+)>c(CH3COO-)>cOH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
18.室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。
已知CaCO3的溶度积(室温)为2.8×10-9,下列说法 中不正确的是( )
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成a点
D.b点与d点对应的溶度积相等
17.二氧化硫催化氧化反应(接触法制硫酸):2SO2(g)+O2(g)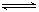 2SO3(g)
2SO3(g)
△H=-196kJ·mol-1 有关叙述错误的是( )
A.一定温度下,增大压强,转化率增大,平衡常数不变
B.2molSO2和1molO2反应放出热量小于196kJ
C.反应物键能之和小于生成物键能之和
 D.焓变△H和熵变△S都有利于反应正向进行
D.焓变△H和熵变△S都有利于反应正向进行
16.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为
KOH溶液,其充、放电按下式进行:
.. Cd
+ 2NiOOH + 2H2O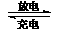 Cd(OH)2
+ 2Ni(OH)2
Cd(OH)2
+ 2Ni(OH)2
.. 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.电池充电时,电池正极和电源的负极连接。
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
15.某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)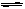 H2(g)+CO2(g)
H2(g)+CO2(g)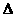 H>0当反应达平衡时,测得容器中各物质均 为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是( )
H>0当反应达平衡时,测得容器中各物质均 为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是( )
A、升温 B、加催化剂
C、再加入n molCO和n molH2O D、再加入2n molCO2和2n molH2
13.高温下,某反应达到平衡,平衡常数K=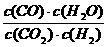 。恒容时,温度升高,H2浓 度变大。下列说法正确的是( )
。恒容时,温度升高,H2浓 度变大。下列说法正确的是( )
A.该反应是焓变为负值
B.恒温下,增大压强,H2浓度一定减小
 C.升高温度,逆反应速率减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2

|
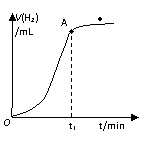
为ρ g/cm3)。下列叙述错误的是( )
A.t1时刻锌镀层已完全反应
B.锌镀层的厚度为
C.反应放热也是影响OA段的反应速率的因素之一
D.有原电池反应发生,负极的电极反应式为Zn- 2e → Zn2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com