
题目列表(包括答案和解析)
10.下列各选项所述的两个量,前者一定大于后者的是
①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;③NaCl的晶格能与MgO的晶格能;④F元素和O元素的电负性;⑤N和O元素的第一电离能;⑥H原子和H+离子的半径
A.①④⑤ B.②④⑥ C.④⑤⑥ D.③⑤⑥
8.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA
B.标准状况下,2.24 L Cl2与足量的水反应,转移的电子总数为0.2NA
C.室温下,40.0 g SiC 晶体中含有C-Si键的数目为4NA
D.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
|
B.Y元素气态氢化物的还原性最强
C.X元素的非金属性比Y元素非金属性强
D.Z和X可能以共价键结合形成一种无机非金属材料
7.下列叙述中,结论(事实)和对应的解释(事实)均不正确的是
A.金刚石的熔沸点高于晶体硅,因为C一C键能大于Si一Si键能
B.稀有气体的晶体属于原子晶体,因为其构成粒子间作用力为共价键
C.NH4+ 与Cu2+ 间不能形成配位键,因为NH4+ 中N 原子不存在孤对电子
D.p轨道之间只能形成π键,因为p轨道与p轨道之间只能以“肩并肩”方式重叠
6.
 有一未完成的离子方程式:
+XO3-+6H+=3X2+3H2O,据此判断X元素的最高化合价为
有一未完成的离子方程式:
+XO3-+6H+=3X2+3H2O,据此判断X元素的最高化合价为
A.+7 B.+5 C.+4 D.-1
5.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是
A.Na+、K+、Cl-、OH- B.H+、Na+、SO42-、NO3-
C.K+、Ca2+、NO3-、SO32- D.Na+、Mg2+、S2-、MnO4-
4.氮化钠和氢化钠与水反应的化学方程式如下:Na3N + 3H2O =3NaOH + NH3,
NaH + H2O =NaOH + H2↑。有关Na3N和NaH的叙述正确的是
A.离子半径:Na+>N3->H+ B.与水反应都是氧化还原反应
C.加热熔化时,都只破坏离子键 D.与盐酸反应都只生成一种盐
3.下列物质的分类正确的是
|
|
混合物 |
非电解质 |
碱 |
酸式盐 |
|
A |
漂白粉 |
氯气 |
氨水 |
碳酸氢钠 |
|
B |
福尔马林 |
苯 |
碱式碳酸铜 |
明矾 |
|
C |
胆矾 |
二氧化硫 |
纯碱 |
氯化铵 |
|
D |
食醋 |
乙醇 |
苛性钾 |
硫酸氢钠 |
2. 下列有关化学用语或名称表达正确的是
下列有关化学用语或名称表达正确的是
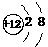 A.Mg的原子结构示意图:
B.乙炔的分子模型示意图:
A.Mg的原子结构示意图:
B.乙炔的分子模型示意图:

C.H2O2的电子式: D.乙烯的结构简式:CH2=CH2
1.由解放军总装备部军事医学研究所研制的小分子团水,具有高渗透力、高扩散力、高溶解力等特点。一次饮用125 mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是
A.水分子的化学性质发生改变 B.水的物理性质改变
C.水分子间以共价键缔合 D.水分子中氢氧键长缩短
20.(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。

江苏省淮州中学2009-2010学年度第二学期高二期末调研测试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com