
题目列表(包括答案和解析)
1.下列叙述正确的是:
A.强电解质都是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,故SO3是电解质
D.硫磺是单质,不导电,因此硫磺是非电解质
26. (6分)在一定温度下,10L密闭容器中加入5molN2、25molH2,经10min后反应达平衡时有2molN2 ,
1)H2的转化率为多少?
第一节 用N2表示该反应的反应速率为多少?
第二节 平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
25. (8分)(09年浙江理综·27)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
1.
时间(s) |
2.
0 |
3.
1 |
4.
2 |
5.
3 |
6.
4 |
7.
5 |
|
8.
c(NO) 9. (mol/L) |
10.
1.00×10-3 |
11.
4.50×10-4 |
12.
2.50×10-4 |
13.
1.50×10-4 |
14.
1.00×10-4 |
15.
1.00×10-4 |
|
16. c(CO) 17. (mol/L) |
18.
3.60×10-3 |
19.
3.05×10-3 |
20.
2.85×10-3 |
21.
2.75×10-3 |
22.
2.70×10-3 |
23.
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
24. (6分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
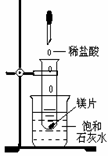 (1)实验中观察到的现象是
(1)实验中观察到的现象是
。
(2)产生上述现象的原因是
。
(3)写出有关反应的离子方程式 。
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
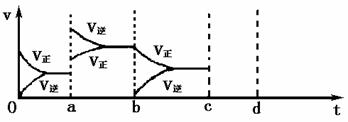
23. (1)(3分)右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a到b过程中改变的条件可是:
;
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a到b过程中改变的条件可是:
;
b到c过程中改变的条件可能是 ;
若增大压强时,反应速度变化情况画在c-d处.
(2)(4分)反应2A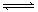 B+C,在某一温度时,达到平衡
B+C,在某一温度时,达到平衡
① 若温度升高,化学平衡常数变小,则正反应是_____热反应。
② 若B是固体,降低压强时,平衡向左移动,则A是_____态。
③ 若A是气态,加压时,平衡不移动,则B为_____态,C为____态
21.(9分)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡.
NH3+H2O 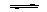 NH3·H2O
NH3·H2O
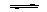 NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OH-的浓度__________, NH4+的浓度_____。 (2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有___________、___________、___________。 (3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 _________ 。 22. (4分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式_____________________________________________________________,
若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的
△H=______________
kJ· 。
。
20.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的容器中,发生反应:
2SO2+O2 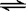 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
A.2 mol SO2 + 1 mol O2
B.1mol SO2 + 1 mol O2
C.2 mol SO2 + 1 mol O2 + 2 mol SO3
D.1 mol SO2 + 2 mol SO3
第Ⅱ卷(非选择题,共40分)
19.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1mol共价键(或其逆过程)时释放(或吸收)的能量。已知H─H键的键能为436kJ/mol,Cl─Cl键的键能为243kJ/mol,H─Cl键的键能为431kJ/mol,则H2(g)+Cl2(g)=2HCl(g)的反应热(△H)等于( )
A.-183 kJ/mol B. 183 kJ/mol C. -862 kJ/mol D. 862 kJ/mol
18. 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2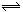 2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 ( )
2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率 ( )
A.等于P% B.小于P% C.大于P% D.无法判断
17. 在两个恒容容器中有平衡体系:A(g) 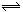 2B(g)和2C(g)
2B(g)和2C(g) 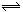 D(g),X1和X2分别是A和C的转化率。在温度不变情况下,均增加相同的A和C的物质的量,下列判断正确的是: ( )
D(g),X1和X2分别是A和C的转化率。在温度不变情况下,均增加相同的A和C的物质的量,下列判断正确的是: ( )
A.X1降低,X2增大 B.X1、X2均降低 C.X1增大,X2降低 D.X1、X2均增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com