
题目列表(包括答案和解析)
2.在一定温度下将各lmo1CO和水蒸气放在密闭的容器中反应,CO(气)+H2O(气)⇌CO2(气)+H2(气)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气达到新的平衡后,CO2的物质的量是( )。
A.等于0.6mol B.等于1mol
C.大于0.6mol小于Imol D.大于lmol
答案:C
1.反应mA(气)+nB(气)⇌pC(气),qD(气),测得平均反应速率υ(C)=2υ(B),达到平衡后,若保持温度不变,给体系加压,平衡不移动,则”m、n、p、q的数值正确的是( )。
A.2,6,3,5 B.3,1,2,2 C.3,1,2,1 D.1,3,2,2
答案:B
10.在一密闭容器内加入HBr气体,在一定温度下,建立2HBr⇌+Br2(气)(正反应为吸热反应)的化学平衡,若升高温度:
(1)正反应速率____________,逆反应速率____________。
(2)化学平衡向____________反应方向移动。
(3)混合气的颜色应变____________。
(4)混合气的平均相对分子质量____________。
(5)若将密闭容器的体积减小为原来的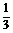 ,则化学平衡____________,混合气的颜色____________。
,则化学平衡____________,混合气的颜色____________。
答案:(1)加快;加快 (2)正 (3)深 (4)不变 (5)不移动;变深
综合练习
9.将等物质的量的A、B、C、D四种物质混合,发生如下反应:
aA+bB⇌cC(固)+dD
当反应进行一段时间后,测得A减少了nmol,B减少了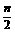 mol,C增加了
mol,C增加了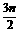 mol,D增加了nmol,此时达到化学平衡。
mol,D增加了nmol,此时达到化学平衡。
(1)该化学方程式中各物质的系数分别为:a____________b____________c____________d____________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态A:____________、B:____________、D:____________。
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为____________反应(填“放热”或“吸热”)。
答案:(1)2;1;3;2
(2)气;固或液;气
(3)放热
8.当密闭容器中反应mA(气)+nB(固)⇌pC(气)已达到平衡后,将密闭容器的体积缩小,发现A的转化率也随之降低。那么下列几个表示化学方程式系数关系的式子中,普遍适用于上述一类反应的是( )。
A. m<p B.m>p C.m+n<p D. m+n>p
答案:A
7.在1 000℃以上的高温,存在下列平衡:C+CO2⇌2CO(正反应为吸热反应),根据热化学方程式,采取什么手段来抑制CO的生成?其答案是( )。
手段:①升温 ②降温 ③加压 ④降压理由:a.放热反应 b.吸热反应 c.气体分子数增加 d.气体分子数减少
A.①④和ad B.②③和bc C.②④和bd D.①③和ac
答案:B
6.在下列平衡体系中,采用括号内的措施后,平衡向正反应方向移动且反应速率增大的是( )。
A.N2(气)+O2(气)⇌2NO(气)(加压)
B.N2(气)+3H2(气)⇌2NH(气)(移出NH3)
C.2SO3(气)⇌2SO2(气)+O2(气)(降温)
D.2NO2(气)⇌N2O4(气)(加压)
答案:D
5.不能用勒沙特列原理解释的是( )。
A.棕红色的二氧化氮加压后颜色先变深后变浅
B.由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.煅烧粉碎的硫铁矿利于SO2的生成
答案:BD
4.反应mA+nB⇌PC,A、B、C代表气体物质的分子式,m、n、p为系数,若反应生成物的浓度在温度升高、压强降低时增大,那么下列式子中正确的是( )。
A.m+n>p(正反应为放热反应) B.m+n<P(正反应为吸热反应)
C.m+n>p(正反应为吸热反应) D.m+n<p(正反应为放热反应)
答案:B
3.化学反应C(固)+H2O(气)⇌CO(气)+H2(气)(正反应为吸热反应)达到平衡,下列叙述中正确的是( )。
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.加入固体炭,平衡向正反应方向移动
C.加入水蒸气使容器内压强增大,平衡向逆反应方向移动
D.扩大容器的容积,平衡向正反应方向移动
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com