
题目列表(包括答案和解析)
20.(13分) 请回答下列(1)、(2)两小题
(1)进行下列各项定量试验,由于某步操作不符合要求,可能会造成结果偏低的有(在本题得分范围内选错倒扣分) 。
A.欲取2.0g食盐,用托盘天平(指针向上),称完读数时指针偏向右边
B.用容量瓶配制溶液,摇匀后,发现液面低于刻度线,于是准确地再滴加蒸馏水到刻度线摇匀
C.用量筒量液体,读数时俯视
D.酸式滴定管滴定后读数时俯视
E.测定晶体硫酸铜结晶水含量,加热坩埚蒸发水分,由于温度超过650℃部分晶体由蓝色变为黑灰色。
F.酸式滴定管滴定后读数时仰视。
(2)碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·XH2O(X=1/2,1,2)为验证其组成并确定X值,某学生设计了以下几步实验
① 取a g的晶体制成粉末。
② 晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③ 另取a g的晶体,溶于足量某溶剂中充分溶解得到溶液。
④ 向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器 (填仪器名称,下同);灼烧晶体时所用仪器是 。
以上四步中,用到玻璃棒的步骤有 (选填:①②③④)
B.步骤②灼烧后得到的固体应为: 。
C.步骤③所用的溶剂可能是 。
D.步骤④主要包括 加入足量硝酸银溶液→ → → 晾干→称量
E.若组成符合通式,则计算X的表达式为: (用字母表示)。
19.铁有δγα三种晶体结构,以下依次是δγα三种晶体不同温度下转化的图示。有关说法不正确的是
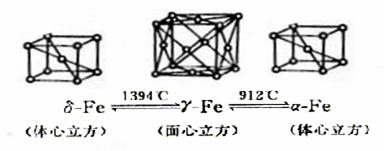
A.δ-Fe晶体中与每个铁原子距离相等且最近的铁原子有8个
B.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有12个
C.如图α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为bcm,则两种晶体密度比为b3∶a3
D.将铁加热到1500oC分别急速冷却和缓慢冷却,得到的晶体类型相同
第II卷(非选择题,共83分)
18.把铝粉与下列氮的气态氧化物混合后,加热至高温,均可生成氮气和氧化铝。若反应后气体的压强是反应前气体压强的1/2(恒温恒压条件下测得),则氮的氧化物是
A.NO B.N2O3 C.N2O D.N2O5
17.已知某溶液中存在OH―、H+、NH4+和 Cl― 四种离子,其浓度大小有如下关系:①c(Cl―)> c(NH4+)> c(H+)> c(OH―) ②c(NH4+)= c(H+)>c(Cl―) > c(OH―)
③c(Cl―)= c(NH4+)且c(OH―)= c(H+) ④c(OH―)> c (H+)> c(Cl―)> c(NH4+)
⑤c(Cl―)> c(H+)> c(NH4+)> c(OH―) ,其中可能正确的是
A.①④ B.②⑤ C.③④ D.①③⑤
16. 在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、C 1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、C 1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
A.平衡时A 、B的物质的量之比不一定为2:1
B.x的值可能是2,也可能是3
C.平衡时A 的物质的量与原平衡一定相等
D.C的体积分数不可能为W%
15.用来表示可逆反应:2A(g)+B(g) 2C(g)(正反应放热) 的正确图象是下图中的
2C(g)(正反应放热) 的正确图象是下图中的
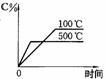
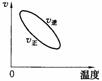
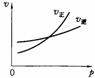
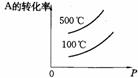
A B C D
14.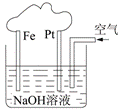 有关右图装置的叙述正确的是
有关右图装置的叙述正确的是
A.这是一个原电池装置
B.这是电解NaOH溶液的装置
C.该装置中Fe为阴极,电极反应为:Fe-2e-+ 2OH- Fe(OH)2
Fe(OH)2
D.该装置中Pt为正极,电极反应为:O2 + 2H2O
+
4e- 4OH-
4OH-
13.下列反应的离子方程式正确的是
A.足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O=2HCO3-
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.醋酸洗涤铜器表面的铜绿:Cu2(OH)2CO3+4H+ = 2Cu2+ +CO2↑+3H2O
D.向碳酸氢钠溶液中滴入过量澄清石灰水
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
12.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl―、I―
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3―
C.水电离出来的c(H+)=10-13 mol/L的溶液:K+、HCO3―、Br―、Ba2+ D.所含溶质为Na2SO4的溶液:K+、CO32―、NO3―、Al3+
11.气态原子生成+1价气态阳离子所需要的能量称为第一电离能。元素的第一电离能是衡量元素金属性强弱的一种尺度。下列说法正确的是
A.元素的第一电离能越大,其金属性越强
B.元素的第一电离能越小,其金属性越强
C.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
D.金属单质跟酸反应的难易,除跟该金属元素的第一电离能有关外,还与该单质中固态金属原子以及该金属原子失去电子后在水溶液里形成的水合离子的行为有关
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com