
题目列表(包括答案和解析)
29、工业上用甲苯生产对- 羟基苯甲酸乙酯HO- -COOC2H5(一种常用的化妆品防霉剂),其生产过程如下(反应条件未全部注明)所示:
-COOC2H5(一种常用的化妆品防霉剂),其生产过程如下(反应条件未全部注明)所示:
|
|
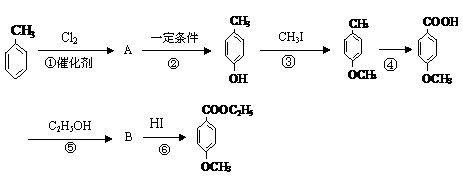

按上图填空:
(1)有机物A的结构简式为
(2)写出反应⑤的化学方程式(有机物写结构简式,注明反应条件)
(3)反应②和反应④的反应类型分别是(选填编号) 、
a.取代反应,b.加成反应,c.消去反应,d.酯化反应,e.氧化反应
(4)写出反应③的化学方程式(有机物写结构简式,不用写反应条件,但要配平)
(5)在合成线路中设计③和⑥两步反应的目的是 。
28、化合物SOCl2是一种液态化合物,沸点为77℃。在盛有10毫升水的锥形瓶中,小心地滴加8 - 10滴SOCl2可观察到剧烈反应,液面上有白雾形成,并有刺激性气体逸出,该气体可以使沾了品红试液的滤纸褪色。
(1)根据上述实验,写出SOCl2和水反应的化学方程式________________________________,
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2跟AlCl3·6H2O混合共热,可得到无水AlCl3,其原因__________________________________________________________。
27、实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。
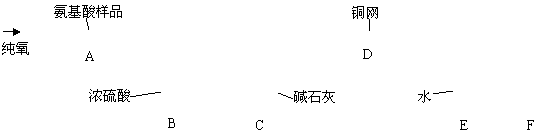
请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是________________________
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是________________________________________。
(4)装置D的作用是______________________________________________________。
(5)读取N2的体积时,应注意①________________________________________;
②_______________________________________________
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是________________________。
26、使用中学常备器材,试设计一个实验证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应。要求作出有关实验原理、过程、现象的说明。
(1)实验原理________________________________________________________________
________________________________________________________________;
(2)实验过程________________________________________________________________
________________________________________________________________;
(3)实验现象________________________________________________________________
________________________________________________________________。
25、在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
 AmBn(s) An+(aq) + Bm-(aq)
AmBn(s) An+(aq) + Bm-(aq)
在一定温度下,当达到平衡时,[An+]m·[Bm+]n为一常数,用KSP表示,称为该温度下该难溶电解质的溶度积。
在一定温度下,当[An+]m·[Bm+]n = KSP时,溶液呈饱和状态,沉淀量既不增加,也不减少;当[An+]m·[Bm+]n > KSP时,溶液呈过饱和状态,将析出沉淀;当[An+]m·[Bm+]n < KSP时,溶液呈不饱和状态,沉淀将溶解;
试根据上述原理,计算:
(1)已知在常温下,FeS的KSP = 6.05×10-18,求此温度下FeS的溶解度______g/100g水。(设饱和溶液的密度为1 g/mL)。
(2)又已知H2S饱和溶液在常温下,[H+]与[S2- ]存在着以下关系:[H+]2·[S2- ]= 1.0×10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为____________。
24、下表列出了① ~ ⑩十种元素在周期表中前四周期的位置,请回答下列问题:
 主族族数 主族族数周期序数 |
|
|
|
|
|
|
|
|
|
|
|
|
|
⑤ |
|
⑥ |
⑧ |
|
|
|
① |
③ |
④ |
|
|
⑦ |
|
⑩ |
|
|
② |
|
|
|
|
|
⑨ |
|
(1)在这十种元素形成的单质中化学性质最不活泼的是____________;(填具体元素的符号或化学式,下同。)金属性最强的是_______________;非金属性最强的是__________。
(2)①、③两元素的氧化物对应的水化物中碱性强的是_______________;(填具体物质的化学式,下同。)⑤、⑦两元素的最高价氧化物对应的水化物中酸性强的是________。
(3)①、②、③三元素按原子半径由小到大的顺序排列为______________________。
(4)用电子式表示②、⑨两元素形成化合物的过程____________________________。
(5)①的氧化物对应的水化物与⑦的氢化物反应的离子方程式,因物质的量配比不同产物有所不同,试分别写出有关反应的离子方程式____________________________________ _______________________________________________。
23、为了防止生锈,可对铁制品表面进行“发蓝”处理:把铁制品浸入热的NaNO2、NaNO3、NaOH混合溶液中,使它的表面氧化生成一层致密的Fe3O4氧化膜(Fe3O4可以看成是Fe2O3和FeO的复合化合物),所发生的反应可以表示如下:
①3Fe + NaNO2 + 5NaOH → 3 Na2FeO2 + NH3 + H2O
② Fe + NaNO3 + NaOH + →3 Na2Fe2O4 + NH3
 ③Na2FeO2
+ Na2Fe2O4 +
2H2O Fe3O4
+ 4 NaOH
③Na2FeO2
+ Na2Fe2O4 +
2H2O Fe3O4
+ 4 NaOH
(1)请配平反应②的化学方程式,将结果填入题②中方框内。
(2)Na2FeO2称亚铁酸钠,Na2Fe2O4的名称是___________________。
(3)若上述热的混合液中NaOH的含量太少,则氧化膜的厚度就太薄,其原因可能是___ _________________________________________________________________________,若NaOH的含量太多,则氧化膜的厚度也太薄,其原因可能是_____________________ ______________________________________________________________________________________________________。
22、在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为P1。若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2。则P1和P2之间的关系是
A、P1=8P2 B、P1= 4P2 C、P1=2P2 D、P1=P2
第二卷(共84分)
21、一定条件下,在密闭容器里进行如下可逆反应:
 S2C12(l,橙黄色) 十 C12(g)
2SCl2(l,鲜红色)十51.16
kJ
S2C12(l,橙黄色) 十 C12(g)
2SCl2(l,鲜红色)十51.16
kJ
下列说法错误的是
A、单位时间里生成n molS2Cl2:,同时也生成n molCl2 (g),则反应达到平衡
B、达到平衡时,若升高温度,压强不变,反应混合液颜色由鲜红色变橙黄色
C、达到平衡时,单位时间里有n molS2C12消耗,同时有n molCl2(g)生成
D、其他条件不变,增加氯气,平衡向正反应方向移动,氯气的转化率增大
20、室温下,某溶液中由水电离出来的量H+和OH-浓度的乘积为10-24。在该溶液中,一定不能大量存在的离子是
A、S2O32- B、NH4+ C、NO3- D、HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com