
题目列表(包括答案和解析)
21.(10分)Ⅰ.下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
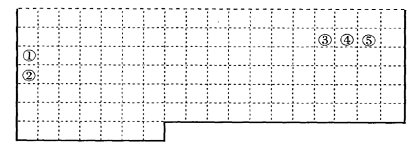
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个,元素③氢化物的电子式为_______。
(3)元素④-般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
 a.元素①的单质 b.元素②的单质
a.元素①的单质 b.元素②的单质
c.元素①②形成的合金 d.无法判断
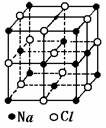
Ⅱ.已知NaCl的摩尔质量为Mg·mol-1,食盐晶体的密度为ρg·cm-3,
若右图中Na+与最邻近的Cl-的核间距离为acm,那么阿伏加德罗常数
的值可表示为
20.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-,下列有关说法中正确的是( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以1mol物质得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaClO3 + H2SO4 = 2Na2SO4 + 2ClO2↑+ H2O
19.硅橡胶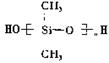 是由二甲基二氯硅烷(
是由二甲基二氯硅烷(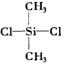 )经两种反应而制得的,这两种反应依次是
)经两种反应而制得的,这两种反应依次是
A.消去、加聚 B.水解、缩聚 C.氧化、缩聚 D.取代、缩聚
18.甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
(CH3)2 C=O + HCN -→ (CH3)2 C(OH)CN
(CH3)2C(OH)CN + CH3OH + H2SO4 -→ CH2=C(CH3)COOCH3 + NH4HSO4

|
与旧法比较,新法的优点是:
A、原料无爆炸危险 B、原料都是无毒物质
C、没有副产物,原料利用率高 D、对设备腐蚀性较小
17.近几年一种新型的甜味剂--木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为:CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是:
A、木糖醇是一种五元醇
B、木糖醇是一种无糖型植物甜味剂
C、木糖醇跟葡萄糖、果糖一样,属于单糖
D、木糖醇理论上可以分子内脱水生成环醚
16.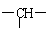 某链状有机物分子含n个-CH2-,m个 ,a个-CH3,其余为羟基。则羟基个数为:
某链状有机物分子含n个-CH2-,m个 ,a个-CH3,其余为羟基。则羟基个数为:
A、2n+3m-a B、n+m+a C、m+2-a D、m+2n+2-a
15.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是
A.反应开始时的速率:甲=乙 B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙 D.反应结速时,pH值:甲<乙
14.已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A、H2O(g)=H2(g)+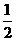 O2(g);
O2(g);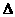 H= +242kJ·mol-1
H= +242kJ·mol-1
B、2H2(g)+O2(g)+2H2O(l);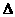 H= -484kJ·mol-1
H= -484kJ·mol-1
C、H2(g)+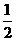 O2(g)=H2O(g);
O2(g)=H2O(g); H= +242kJ·mol-1
H= +242kJ·mol-1
D、2H2(g)+O2(g)=2H2O(g); H= -484kJ·mol-1
H= -484kJ·mol-1
13.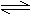 可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
12.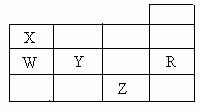 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com