
题目列表(包括答案和解析)
23.(10分)(此题生化班做)氰化钾、氰化氢的制备反应式为:
K2CO3+C+2NH3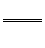 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
CO+NH3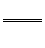 HCN+H2O;△H=+46kJ/mol ②
HCN+H2O;△H=+46kJ/mol ②
⑴氰离子为负一价(CN-),其中碳氮元素的化合价分别为__2分 ______。 以上两个反应是否均为氧化还原反应? 2分
⑵制备纯净无水HCN(沸点299K)的另一种方法是 :混合磨细的KCN和KHS粉末适度加热
①试写出这个反应式。 2分 ②为什么要磨细和用粉末? 2分
③为什么要强调适度加热? 2分
[解析] 据共价键理论,一般当碳同非金属性比它强的元素结合时,碳显正价,氮为负价,为-3价,所以(CN-)中碳为+2价,氮为-3价。故①为氧化还原反应,②为非氧化 还原反应。第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率,据题意知,第二种方法制备HCN如温度太低,反应速率较小,温度太高,则酸式盐易分解发生副反应:2KHS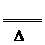 K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS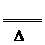 HCN↑+K2S。
HCN↑+K2S。
23. (1) Cl,
NH3+ HCl = NH4Cl (2) NH4++H2O NH3·H2O
(1) Cl,
NH3+ HCl = NH4Cl (2) NH4++H2O NH3·H2O
 (3) ①
BiCl3+H2O BiOCl+2HCl ②盐酸抑制BiCl3水解,BiOCl中的Cl为-1价
(3) ①
BiCl3+H2O BiOCl+2HCl ②盐酸抑制BiCl3水解,BiOCl中的Cl为-1价
23.(10分)(此题物化班做) A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10。B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18。A、B、D能形成一种离子化合物,其水溶液成弱酸性,请写出:
(1)C的元素符号 1分 ,X跟Y反应的化学方程式 2分 。
(2)用离子方程式解释A、B、D形成的化合物水溶液呈弱酸性的原因是 2分 。
(3)铋(Bi)跟C元素能形成化合物(BiC3),其水解生成难溶于水的(BiOC)。
① BiC3水解反应的化学方程式为 2分 。
②把适量的BiC3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因。 2分
③医药上把BiOC叫做“次某酸铋”,分析这种叫法的不合理之处。 1分
13.(1)①酚酞 ②FeCl3 ③甲基橙 ④AlCl3 (2)CO2
22.(6分)下图为喷泉实验装置图。
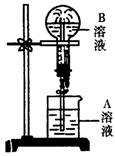
(1)若大烧瓶内充入的为干燥NH3,要使喷泉形成表中的各种颜色,请写出A溶液里溶质的名称或化学式。
|
编号 |
A溶液颜色 |
B溶液颜色 |
A溶液中溶质 |
|
① |
无色 |
红色 |
1分 |
|
② |
黄色 |
红褐色浑浊 |
1分 |
|
③ |
橙色 |
黄色 |
1分 |
|
④ |
无色 |
白色胶状沉淀 |
1分 |
(2)若大烧瓶内充的是不易形成喷泉的含氧72.7%的XO2气体,但如果加入固体YOH 再作轻轻振荡后,则可形成喷泉。实验后取烧瓶内溶液作焰色反应,其焰色为浅紫色,则XO2的化学式为____2分 ____。
21.(1)113 ~ 450℃,-2、+4、+6;(2)H2Te>H2Se>H2S;(3)2H2Se + O2 == 2H2O + 2Se
(4)①H2O2、H2S的电子式②稳定性越大,△H越小③H2Se(g)=H2(g)+Se(s) △H= - 81KJ/ mol
21.归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表格回答下列问题:
(1)硒的熔点范围可能是 1分 碲的化合价可能有 1分
(2)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 2分 (填化学式)
 (3氢硒酸有较强的还原性,因此放在空气中长期保存易变质,其可能发生的化学方程式为______________2分 ___________________。
(3氢硒酸有较强的还原性,因此放在空气中长期保存易变质,其可能发生的化学方程式为______________2分 ___________________。
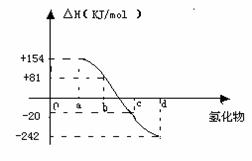
(4)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物放出或吸收的热量叫该化合物的生成热。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。请回答下列问题:
①写出氧族元素中含18电子的两种氢化物的电子式__2分 __________
②请你归纳:非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系________________________
③写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_____2分 _____________________
20. ⑴①接触室 ②点燃 ③4FeS2+11O2 2Fe2O3+8SO2; ⑵ ①Na+[
2Fe2O3+8SO2; ⑵ ①Na+[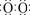 ]2-Na+ ② 2Al+2OH-+2H2O=2AlO2-+3H2↑
③ 4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1
]2-Na+ ② 2Al+2OH-+2H2O=2AlO2-+3H2↑
③ 4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8 kJ·mol-1
20.(10分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
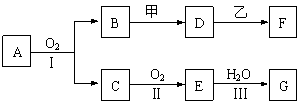
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在______1分_________中进行。
②工业上制备甲的反应条件是___1分________。
③反应Ⅰ的化学方程式是______________2分______________________________。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是___2分_________。
②D的溶液与乙反应的离子方程式是______________2分____________________。
③若1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式:___________________________2分_______________________________。
19.(8分)在化工生产中,要用到一种无色、可溶于水的晶体:铝铵矾。该晶体是一种复盐,其主要成分是十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化。
试回答:
(1)硫酸铝铵在水溶液中的电离方程式为___2分 ___;
(2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气味的气体产生;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀量逐渐减少。
请答出各种现象由先到后出现的顺序(用序号回答)____→____→____→____→____;2分
(3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:②__2分 __________;⑤_____________2分_____。
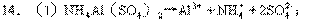
(2)①→③→②→⑤→④;
(3)①Al3++3OH-→Al(OH)3↓②NH4++OH-→NH3↑+H2O
⑤Al(OH)3+OH-→AlO2-+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com