
题目列表(包括答案和解析)
8.下列说法中正确的是(NA表示阿伏加德罗常数)( )
A.28 g氮气含有的原子数目为NA
B.4 g金属钙变成钙离子时失去的电子数目为0.1NA
C.1 mol甲烷的质量与NA个甲烷分子的质量之和相等
D.22.4 L甲烷与乙炔的混合物所含分子数为NA
7.下列实验操作会导致实验结果偏低的是( )
(1)配制100 g 10%的CuSO4溶液,称取10g CuSO4晶体溶于90 g水中
(2)测定CuSO4晶体中结晶水的百分含量时,所用的晶体已经受潮.
(3)配制一定物质的量的浓度的H2SO4溶液,定容时仰视容量瓶的刻度线.
(4)用98%的浓H2SO4配制1∶5稀H2SO4时,把14 g98%的浓H2SO4溶于54 g水中
A.只有(1) B.只有(2) C.(2)(3)(4) D.(1)(3)(4)
6. 下列离子方程式正确的是( )
A.醋酸铵和盐酸反应CH3COONH4+H+ CH3COOH+NH4+
B.氢氧化钡与碳酸氢镁反应Ba2++OH-+HCO3- BaCO3↓+H2O
C.偏铝酸钠和过量盐酸AlO2-+4H+ Al3++2H2O
D.钠跟水反应Na+2H2O Na++2OH-+H2↑
5.已知在酸性溶液中,下列物质氧化Fe2+时,自身发生如下变化HNO3→NO;Br2→2Br-;ClO-→Cl-;MnO4-→Mn2+ 如果分别用等物质的量的这些物质氧化足量的FeCl2溶液,得到Fe3+最多的( )
A.HNO3 B.Br2 C.ClO- D.MnO4-
4. 关于如右图所示装置的叙述,正确的是( )
A 铜是阳极,铜片上有气泡产生
B 铜片质量逐渐减少
C 电流从锌片经导线流向铜片
D 氢离子在铜片表面被还原
3.Na3N是离子化合物,它和水作用可产生NH3,下列说法正确的是( )
A.Na+和N3-的电子层结构都与氖原子相同 B.Na+的半径大于N3-的半径
C.Na3N与盐酸反应可生成两种盐 D.Na3N和水反应时,Na3N是还原剂

2.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
1.据报道,科学家用激光将置于铁室中石墨靶上的碳炸松,与此同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜.这种化合物比金刚石更坚硬,其原因可能是( )
A.该化合物为离子晶体 B.碳氮键比金刚石中碳碳键更短
C.碳氮的单质化学性质均不活泼 D.氮原子最外层电子数比碳原子多
24.(8分)2 g Cu2S和CuS的混合物在酸性溶液中用400ml 0.075 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

MnO4- + Fe2++ H+= Mn2++ Fe3+ + H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 _ g。
(4)混合物中 Cu2S的质量分数为 。
23.(6分)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为 。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 (用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
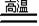
2 Fe2O3十C 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com