
题目列表(包括答案和解析)
1]A12Te3 + [ 6 ] HO ==[ 2 ]A1(OH)3↓+[ 3 ]H2Te↑
⑷已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。上图为氧族元素氢化物a、b、c、d的生成热数据示意图。请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
⑸写出硒化氢在热力学标准态下,发生分解反应的热化学方程式 。
18.(10分) 归纳整理是科学学习的重要方法之一。某同学在学习了氧族元素的各种性质后,归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请你参与并协助他完成相关学习任务:
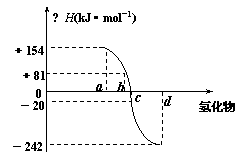 ⑴硒的熔点范围可能是: 113 ;
⑴硒的熔点范围可能是: 113 ;
⑵写出氧族元素中含有18e-的两种氢化物的电子式 -450 -4℃ ;
⑶工业上Al2Te3可用来制备H2Te,完成下列化学方程式并配平:
17.(10分)两套如图所示装置,各盛有2g锌粒(颗粒大小相同),分别加入40mL1mol/L的硫酸和40mL4mol/L的硫酸,比较二者收集10mLH2时所用的时间。
(1)当收集到10mLH2时,哪个实验所耗时
间较长?为什么? 。
(2)两个实验的现象相同的有 ;不同的有 。
(3)注射器针筒活塞外移的情况是
A、均匀外移 B、先快后慢 C、先慢后快 D、先慢后快然后又逐渐变慢
你选择的理由是 。
(4)当按如图所示装置装配好仪器和加入试剂后,开始实验的第一步操作是 。
16.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n<p+q
B. 若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)mol
D.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量之比一定等于m∶n
第二卷(非选择题 共86分)
15.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效 的烯烃复分解催化剂。工业上冶炼钼的化学原理为
① 2MoS2+7O2
 2MoO3+4SO2 ②
MoO3+2NH3·H2O==(NH4)2MoO4+H2O
2MoO3+4SO2 ②
MoO3+2NH3·H2O==(NH4)2MoO4+H2O
③ (NH4)2MoO4+2HCl==H2MoO4↓+2NH4Cl ④ H2MoO4==MoO3+H2O
⑤ 用还原剂将MoO3还原成金属钼。
则下列说法中正确的是
A.MoS2煅烧产生的尾气可用于硫酸工业
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
14.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,
②H-和H+离子半径,
③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量,
④金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数,
⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,
⑥耐火材料MgO和CaO的熔点,
A.①②⑤⑥ B.①②③⑤ C.①⑤⑥ D.①②⑥
13.下列离子方程式书写正确的是
A.醋酸洗涤铜器表面的碱式碳酸铜 Cu2(OH)2CO3 +4H+ = 2Cu2+ +CO2↑+3H2O
B.氧化铁溶于氢碘酸 Fe2O3+6H+=2Fe3++3H2O
C.氯酸钾与浓盐酸制取少量氯气 6H+ + ClO3- + 5Cl- = 3Cl2 ↑ +3H2O
D.明矾溶液加入Ba(OH)2溶液至沉淀质量最多
2Al3++3SO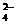 +3Ba2++6OH
+3Ba2++6OH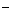 =2Al(OH)3↓+ 3 BaSO4↓
=2Al(OH)3↓+ 3 BaSO4↓
12.有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中有一种是氩元素,则关于另外两种元素的说法正确的是
A.如果一种元素是金属元素,则另一种元素一定是稀有气体元素
B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
C.如果一种元素的气态氢化物是三角锥形分子,则另一种元素的气态氢化物一定是正四面体形分子
D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体
11.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相
继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
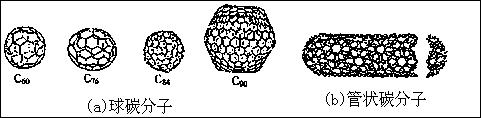
A.熔点比较:C60<C70<C90<金刚石<石墨
B.已知C(石墨,s) C(金刚石,s);△H>0,则石墨比金刚石稳定
C(金刚石,s);△H>0,则石墨比金刚石稳定
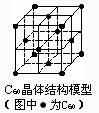 C.C60晶体(其结构模型如右图)中每个C60分子周围与它距离最
C.C60晶体(其结构模型如右图)中每个C60分子周围与它距离最
近且等距离的C60分子有12个
D.金刚石为非分子形式的粒子存在,属原子晶体;C60、C70、管
状碳和洋葱状碳以分子形式的粒子存在,属分子晶体。两类
不是同素异形体
10.NA代表阿伏加德罗常数,下列说法正确的是
A.12g金刚石中含有碳碳键的个数为2NA
B.常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
C.32g皇冠硫(S 8)与足量的Cu反应时转移NA个电子
D.标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com