
题目列表(包括答案和解析)
1.40g 1.79g
x=24.3
所以,该碱金属的相对原子质量应满足24.3<x<61.03,只有K符合。
设a、b分别为K和K2O的质量:
依反应方程式得 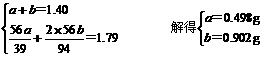
∴w(K)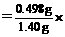 100%=35.6%
100%=35.6%
 例题2-3-9
例题2-3-9
有一在空气中暴露过的NaOH固体,经分析知其含水7.65%,含Na2CO3 4.32%,其余是NaOH,若将1g该样品放入含有3.65g HCl的盐酸中,使其完全反应后,多余的酸再用50g浓度为 2%的NaOH溶液恰好中和完全,蒸发所得溶液至干,求所得固体的质量。
 解析与答案
解析与答案
此题数据众多,反应繁杂,若使用传统计算方法,耗时多,效率低。如果依反应过程分析体系中粒子的种类,结合元素原子守恒,

存在Cl元素守恒: NaCl Cl-
Cl- HCl
HCl
1.40g 1.79g
x=61.03
若1.40g只是M2O: M2O +H2O=2MOH
2x + 16 2 (x+17)
(x+17)
1.2
O2 - 1 0.8
所以:n(O2 2-)∶n(O2 -)=1∶4
答案:C
 例题2-3-4
例题2-3-4
某物质的分子组成为CxHyOz,取该物质m g在足量的O2中充分燃烧后,将产物全部进入过量的Na2O2中,若Na2O2固体的质量也增加mg,则该物质分子组成中必须满足( )
A. x=y=z B. x=y C. y=z D. x=z
 解析与答案
解析与答案
根据质量守恒首先将此化合物的燃烧方程写出:
CxHyOz +( x +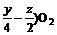 →xCO2 +
→xCO2 + 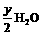
2CO2 + 2Na2O2=2Na2CO3 + O2
x
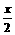
2H2O + 2Na2O2=4NaOH + O2↑
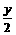
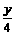
要达到题目中的要求需:
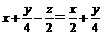
x=z
答案:D
 例题2-3-5
例题2-3-5
金属钾在氧气中燃烧生成超氧化钾KO2,KO2与CO2或H2O反应均生成O2。先将一定量的钠钾合金在足量氧气中燃烧,再将反应物投入水中,并通入足量的CO2,充分反应后,放出氧气的最大体积是被吸收的CO2最大体积的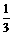 ,则原钠钾合金中钠和钾的质量比为( )
,则原钠钾合金中钠和钾的质量比为( )
 解析与答案
解析与答案
|
K + O2=KO2
4KO2 + 2H2O=4KOH + 3O2↑
CO2 + KOH=KHCO3
|
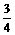 O2,由1个钾原子生成O2与消耗CO2的体积比为
O2,由1个钾原子生成O2与消耗CO2的体积比为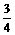 ,
,
同理:4Na + O2=2Na2O2
2Na2O2 + 2H2O=4NaOH + O2↑
NaOH + CO2=NaHCO3
合并化简得:4Na-2Na2O2-4CO2-O2即Na-CO2-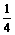 O2,由1个钠原子生成O2与消耗CO2的体积比为
O2,由1个钠原子生成O2与消耗CO2的体积比为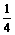 ,
,
K 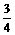
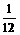
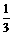
Na 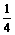
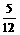
所以钾原子个数与钠原子个数比为1∶5
m(Na)∶m(K)=5×23∶39=115∶39
答案:115:39
 例题2-3-6
例题2-3-6
下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾。试综合上述命名规律,分析回答:Na2CS3应读做( )
A.硫代碳酸钠 B.多硫碳酸钠
C.过硫碳酸钠 D.超硫碳酸钠
 解析与答案
解析与答案
此题为信息迁移题。据题意分析:硫代硫酸钠(Na2S2O3)表明Na2SO4分子中的一个氧原子被一个硫原子代替,代替氧的硫原子化合价仍为-2价,而多硫化钙表明普通硫化钙又与硫结合后的产物,硫的价态发生了改变;过氧化物中含有过氧根离子即O2 2-,超氧化物中含有超氧根离子即O2 -,它们的价态都与原先氧的价态不同,综上分析应选A。
答案:A
 例题2-3-7
例题2-3-7
某物质灼烧时,焰色反应呈黄色,下列判断正确的是( )
A.该物质一定含钠元素
B.该物质一定是钠的化合物
C.该物质一定是金属钠
 D.不能确定该物质中是否含钾元素
D.不能确定该物质中是否含钾元素
 解析与答案
解析与答案
焰色反应的作用是检验某些金属或金属离子的存在。
焰色为黄色证实有Na元素,可能是单质,也可能是化合物。K元素的确定应是: 透过钴玻璃滤去黄光呈紫色。
答案 A、D
 例题2-3-8
例题2-3-8
将1.40g碱金属(M)及其氧化物(M2O)的混合物与水反应,蒸发、结晶得干燥的MOH1.79g。
(1) 该碱金属是何种金属?
(2) 混合物中碱金属单质所占的质量分数。
 解析与答案
解析与答案
解析:由于碱金属不能直接确定,传统解法中可采用排除法进行计算,就是将每一种碱金属逐一代入进行尝试,缺点是计算繁杂、耗时多。
另一种方法就是采用极限讨论法:假定1.40g只是碱金属或只是氧化物,分别求得两种情况时碱金属的相对原子质量,再进行比较分析、判断。
解: 设M的相对原子质量为x,M2O的相对原子质量为2x+16
若1.40g只是碱金属:2M+2H2O=2MOH+H2↑
2x 2 (x+17)
(x+17)
10.8 g 16 g
列出比例求得M=10.69
由平均值原理:10.69<M<35.3,符合此条件的碱金属是钠。
(2) 设10.8 g混合物中Na和Na2O质量分别为x g,yg,则:
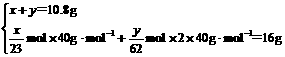
解得: M(Na)=x=4.6 g
M(Na2O)=y=6.2 g
答案: (1)此碱金属为钠
(2)M(Na)=4.6 g M(Na2O)=6.2 g
 例题2-3-3
例题2-3-3
铷在氧气中剧烈燃烧生成棕色的过氧化铷(Rb2O2)和深棕色的超氧化铷(RbO2)的混合物。测得某次燃烧后所得混合物中铷的质量分数为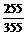 则其中过氧根离子(O22-)和超氧根离子(O2-)的物质的量之比为(
)
则其中过氧根离子(O22-)和超氧根离子(O2-)的物质的量之比为(
)
A. 1∶1 B. 4∶1 C. 1∶4 D.任意比
 解析与答案
解析与答案
根据题意,在混合物中Rb+与O22-及O2-的物质的量之比为:
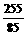 ∶
∶ =3∶2.5,那么在混合物中两种
=3∶2.5,那么在混合物中两种
氧离子的平均化合价为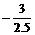 =-1.2,根据十字交叉法:
=-1.2,根据十字交叉法:
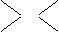 O2 2- 2 0.2
O2 2- 2 0.2
10.8 g 16 g
列出比例求得M=35.3
假设10.8g全部是该金属氧化物R2O,则:
R2O + H2O=2ROH
2M + 16 2(M + 17)
7.8 g 0.2 g
得: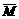 =39
=39
由于合金的平均相对原子质量为39,铷的相对原子质量是85.5,所以另一种碱金属的相对原子质量必定小于39。Li为6.9,Na为23,符合题意。
答案:A、B
 例题2-3-2
例题2-3-2
取10.8 g由碱金属(B)及其氧化物(R2O)组成的混合物,使之与足量的水反应,蒸发后溶液得16.0g无水晶体。问:(1)该金属是哪种金属?(2)原混合物中R和R2O的质量各是多少?
 解析与答案
解析与答案
解决此题可用“极端假设”法,其依据仍为平均值原理。
设: 此碱金属的相对原子质量为M,则16 g的固体为ROH。
(1) 假设10.8 g全部是碱金属R,则:
2R + 2H2O = 2ROH + H2↑
2×M 2(17+M)
3. 碱金属元素
碱金属元素
 例题2-3-1
例题2-3-1
铷和另一种碱金属的合金7.8 g,与足量的水完全反应后,放出氢气0.20 g,则合金中另一种碱金属可能是( )
A. Li B. Na C. K D. Cs
 解析与答案
解析与答案
对于两种物质的混合物,可根据混合物的平均质量、平均体积、平均相对原子(分子)质量等,求出混合物的组成、质量比等。
解:因合金是由碱金属组成,故设:合金为R,平均相对原子质量为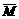 。
。
2R+2H2O=2ROH+H2↑
2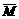 2
2
58.5 143.5
y 12.26g
求得:x=42g y=5g
则:m(Na2CO3)=100-x-y=53g。
各物质的质量分数分别为: w(Na2CO3) 100%=53%;
100%=53%;
w(NaHCO3)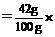 100%=42%;
100%=42%;
w(NaCl)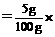 100% = 5%。
100% = 5%。
 例题2-2-15
例题2-2-15
向含NaOH8g的NaOH溶液中通入CO2,生成盐的质量为13.7g, 求参加反应的CO2的质量。
 解析与答案
解析与答案
解析: 首先要分析产物13.7g是Na2CO3还是NaHCO3,或是两者的混合物。可采用极限法加以讨论(即8gNaOH只生成Na2CO3或只生成NaHCO3时其质量各是多少)。
2NaOH + CO2=Na2CO3+H2O
80 106
8g m (Na2CO3)
m(Na2CO3)=10.6g
NaOH+CO2=NaHCO3
40 84
8g m(NaHCO3)
m(NaHCO3)=16.8g
因为10.6g<13.7g<16.8g
所以产物是Na2CO3与NaHCO3组成的混合物。
设参加①反应的NaOH为xg,参加②反应的NaOH为yg。
① 2NaOH + CO2=Na2CO3+H2O; ②NaOH+CO2=NaHCO3
80 44 106 40 44 84
xg 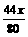 g
g  g
yg
g
yg 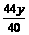 g
g 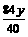 g
g
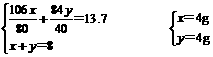
∴
参加反应的总CO2为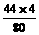 g+
g+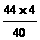 g=6.6g
g=6.6g
18.4 g m(理论)
可得:m(理论)=2.67g,
而真实失重为:18.4 g-16.6 g=1.8 g,
m(真实)<m(理论),说明反应是按
n(NaHCO3)∶n(NaOH)<1∶1,即NaOH过量进行的,所以应以NaHCO3的量为计算依据。
|
NaHCO3 + NaOH=Na2CO3 + H2O↑ 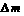
84 18
x 1.8 g
可得:x=8.4g,
混合物中NaOH的质量分数为:
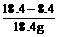 ×100%=54.3%。
×100%=54.3%。
答案:混合物中NaOH的质量分数为54.3%。
 例题2-2-5
例题2-2-5
如图2-1所示,烧瓶内有一只活的小鼠,U形管内装有红色水溶液,使a,b两端的液面处于同一水平面。两天后,U形管内液面发生的变化是( )
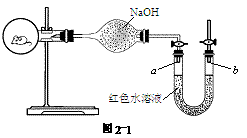
A.a端下降,b端上升 B.a端上升,b端下降
C. a,b两端都下降 D. a,b两端都上升
 解析与答案
解析与答案
此题根据压强原理。因为小鼠吸氧呼出CO2气,且CO2又被NaOH吸收,故烧瓶内的气体越来越少,压强变小,而b端仍是一个大气压,所以a端上升,b端下降。
答案:B
 例题2-2-6
例题2-2-6
将一定量的NaOH与NaHCO3的混合物X,放在一个密闭容器中加热,充分反应后生成气体V1L(V1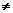 0)。将反应后的固体残留物Y与过量盐酸反应,又生成CO2 V2 L。(气体体积在标准状况下测定)
0)。将反应后的固体残留物Y与过量盐酸反应,又生成CO2 V2 L。(气体体积在标准状况下测定)
(1) Y的成分是_____
A. Na2CO3和NaOH
B. Na2CO3和NaHCO3
C. Na2CO3
D. NaOH
(2) X中NaOH和NaHCO3共_____mol;
NaOH和NaHCO3物质的量之比为_____。
 解析与答案
解析与答案
本题可用列方程组求解并运用碳元素的守恒求解。
因为V1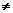 0,X受热发生反应后必无NaOH和NaHCO3剩余,X中的Na+完全转移到Na2CO3(其物质的量为
0,X受热发生反应后必无NaOH和NaHCO3剩余,X中的Na+完全转移到Na2CO3(其物质的量为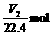 )中。则X中的Na+共
)中。则X中的Na+共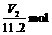 ,所以NaOH和NaHCO3共
,所以NaOH和NaHCO3共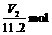 。
。
X中的碳元素全部转化为CO2,共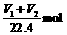 。所以X中的NaHCO3为
。所以X中的NaHCO3为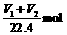 。
。
X中的NaOH为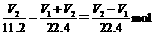 ,所以NaOH与NaHCO3物质的量之比为
,所以NaOH与NaHCO3物质的量之比为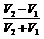 。
。
答案:(1)
C (2) X中NaOH与NaHCO3共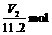 ;它们的比:
;它们的比: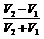 。
。
 例题2-2-7
例题2-2-7
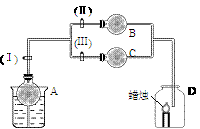
在干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按如图2-2所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
试根据上述实验事实,回答以下各问题:
(1) A中发生的化学反应是_____。
(2) 在装置B中的淡黄色粉末是_____。
(3) 在干燥管C中的白色固体应为_____。
 解析与答案
解析与答案
此题以蜡烛火焰的明亮和熄灭为突破口。明亮一定是通入了O2,而熄灭一般是CO2。由此可确定B中是Na2O2(淡黄色粉末)和CO2的反应;从而可知A是产生CO2的简易启普发生器,C中是一个不与CO2反应的白色固体,即是中性或酸性的固体干燥剂。
答案: (1)CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)Na2O2
(3)CaCl2或P2O5
 例题2-2-8
例题2-2-8
将70 g Na2O2和Na2O的混合物跟98 g水充分反应后,所得NaOH溶液的质量分数为50%,试分别写出Na2O2和Na2O与H2O反应的化学方程式,并计算混合物中Na2O2和Na2O的质量各是多少克?
 解析与答案
解析与答案
此题有多种解法,其中常见的可利用二元一次方程,还可利用一元一次方程法。
方法一:设混合物中Na2O2为x g,Na2O为y g
2Na2O2 + 2H2O=4NaOH + O2↑……①
2×78 4×40 32
x
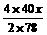
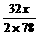
Na2O + H2O=2NaOH……②
62 2×40
y
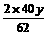
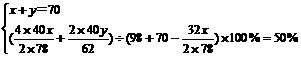
解得:x=39g,y=31g
方法二:设混合物中Na2O2为x g,则Na2O为y=(70-x)g, 同上述②反应,再列出一元一次方程:
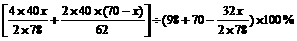 =50%
=50%
解得x=39g,所以Na2O=70-39=31g。
答案:m(Na2O2)=39g,m(Na2O)=31g
 例题2-2-9
例题2-2-9
下列关于Na2O和Na2O2的叙述正确的是( )
A.都是白色固体
B.都是碱性氧化物
C.都能和水反应形成强碱溶液
D.都是强氧化剂
 解析与答案
解析与答案
本题是考查对碱金属氧化物和过氧化物的认识。其知识核心见表。
|
组
成 |
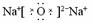 Na2O Na2O |
Na2O2 |
|
电 子 式 |
|
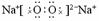 |
|
阳离子与阴离子个数比 |
2:1 |
2:1 |
|
颜色、状态 |
白色粉末 |
淡黄色粉末 |
|
氧元素价态 |
-2 |
-1 |
|
化学性质 |
碱性氧化物 |
氧化性、还原性 |
|
H2O CO2 H+ SO2 |
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 Na2O+2H+=2Na++H2O Na2O+SO2=Na2SO3 |
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2 Na2O2+2H+=2Na++H2O2 2H2O2=2H2O+O2↑ Na2O2+SO2=Na2SO4 |
|
化学特性用途 |
无氧化性、漂白性 |
强氧化性、漂白性医用消毒水、生氧剂、漂白剂 |
通过比较可知:虽然两种氧化物的组成元素相同,但其结构、性质上的差异很大。
答案:C
 例题2-2-10
例题2-2-10
将70g过氧化钠和氧化钠的混合物跟98g水充分反应,所得氢氧化钠溶液的溶质质量分数为50%,试写出过氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各为多少?
 解析与答案
解析与答案
本题解题关键是对所得NaOH溶液的溶质质量分数为50%的分析,可以有两种理解:
(1) 根据溶质质量分数的概念进行计算: w(NaOH) 100%
100%
(2) 根据生成溶液中溶质和溶剂的质量相等进行计算
解:发生的反应为:Na2O+H2O=2NaOH; 2Na2O2+2H2O=4NaOH+O2↑
设混合物中含Na2O2和Na2O的质量分别为x, y
2Na2O2+2H2O=4NaOH + O2↑; Na2O + H2O=2NaOH
2 78 2
78 2 18 4
18 4 40 32 62 18 2
40 32 62 18 2 40
40
x  x
x  x
x 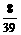 x y
x y  y
y  y
y
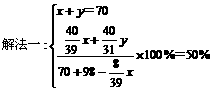
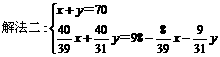
解得:x=39g;y=31g.
答案 (1)2Na2O2+2H2O=4NaOH+O2↑
(2)原混合物中含Na2O2 39g, Na2O 31g。
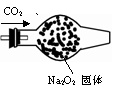
 例题2-2-11
例题2-2-11
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加3.6g,求原混合物中CO2和H2O的质量比。
 解析与答案
解析与答案
|
|

|

 解题思路:
解题思路:
 , 本题涉及Na2O2与CO2和H2O的
, 本题涉及Na2O2与CO2和H2O的
两个反应,且两个反应中均生成O2,所以11.6g的混合气体与Na2O2反应后固体只增重了3.6g,其差量11.6g-3.6g = 8g为生成的O2的质量。
设:CO2和H2O的质量分别为x, y,则
2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH + O2↑
2 44
32 2
44
32 2 18 32
18 32
x
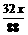 y
y
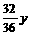

答案: 原混合物中CO2和H2O的质量比为11:18。
 例题2-2-12
例题2-2-12
CO与H2的混合气体3g,在150℃时和足量的氧气燃烧后,将所得CO2和H2O通入到足量的Na2O2后,Na2O2增重的质量为( )
A. 1.5g B. 3g C. 6g D. 无法计算
 解析与答案
解析与答案
反应过程如下
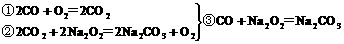
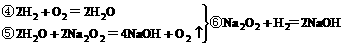
由合并的③、⑥两式看出,Na2O2增重的质量就是CO和H2的质量。
答案:B
 例题2-2-13
例题2-2-13
试列表比较Na2CO3、NaHCO3在物理、化学性质方面的异同及两者的相互转化和工业制备。
 解析与答案
解析与答案
Na2CO3、NaHCO3的比较
|
名 称 |
Na2CO3 |
NaHCO3 |
|||||||
|
俗
名 |
苏打、纯碱 |
小苏打 |
|||||||
|
物理 性质 |
颜色状态 |
白色粉末 |
细小白色晶体 |
||||||
|
水溶性 |
易溶于水 |
较易溶于水 |
|||||||
|
化学 性质 |
热稳定性 |
比较稳定 不易分解 |
2NaHCO3==Na2CO3+H2O+CO2↑ |
||||||
|
H+ |
CO32-+2H+= H2O+CO2↑ |
HCO-3+H+=H2O+CO2↑较Na2CO3快 |
|||||||
|
OH- |
与NaOH不反应 与Ca(OH)2反应生成沉淀 Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH |
NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O |
|||||||
|
CO2 |
Na2CO3+H2O+CO2=2NaHCO3若是饱和Na2CO3溶液,将产生NaHCO3晶体 |
不反应 |
|||||||
|
BaCl2或 CaCl2 |
CO32-+Ba2+=BaCO3↓ CO32-+Ca2+=CaCO3↓ |
不反应 |
|||||||
|
相互转化 |

|
||||||||
|
工业制备 |
2NaHCO3==Na2CO3+H2O+CO2↑ |
饱和氨盐水中通入CO2 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl |
 例题2-2-14
例题2-2-14
今有Na2CO3、NaHCO3和NaCl的混合物100g, 加热到质量不再减少为止,剩余残渣为84.5g,将残渣溶于水,滴入足量AgNO3溶液得到白色沉淀,加足量稀HNO3后大部分沉淀消失,剩余沉淀为12.26g。试计算混合物中Na2CO3、NaHCO3和NaCl的质量分数各是多少?
 解析与答案
解析与答案
解题思路:
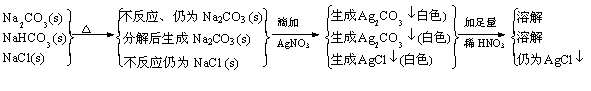
|
2NaHCO3==Na2CO3 + H2O + CO2↑ D m
2 84 18 44 62
84 18 44 62
x 100g-84.5g=15.5g
NaCl + AgNO3=AgCl↓+ NaNO3
18.4 g由NaOH和NaHCO3组成的固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气
体,冷却后称得剩余固体质量为16.6 g。试计算原混合物中NaOH的质量分数。
 解析与答案
解析与答案
|
NaHCO3 + NaOH=Na2CO3 + H2O↑ ①
|
2NaHCO3=Na2CO3 + H2O↑+ CO2↑ ②
因题中并未明确NaHCO3和NaOH哪个过量,故n(NaHCO3)∶n(NaOH),应分以下三种情况讨论:
(1)n(NaHCO3)∶n(NaOH)=1∶1,
(2)n(NaHCO3)∶n(NaOH)>1∶1,
(3)n(NaHCO3)∶n(NaOH)<1∶1。
|
NaHCO3 + NaOH=Na2CO3 + H2O↑ 
 18 18
18 18
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com